JTS CPG (Joint Trauma System Clinical Practice Guideline, 합동외상체계 임상훈련지침)
핵 및 화생방 부상 대응, 파트 2: 화생방 작용제 노출에 대한 의료적 관리
[CPG ID: 69] [본 판 출판일: 2022년 3월 25일] [본 판은 2019년 1월 23일판을 대체함.]
본 지침은 배치된 환경에서의 핵 및 화생방전 사상자 처치에 대한 조직적 접근법으로, 전술적전투부상자처치(TCCC) 지침과 함께 사용하기 위한 것임.
어떤 범주에 넣어야 하나 고민했는데, 일단 핵 및 화생방전하 개인/집단 방호요령 중 하나로 판단해, CBRN으로 위치시킴.
변경점 요약
- Naloxone의 회당 처방량 최신화
- Atropine / Scopolamine SOP 최신화
- 신경 작용제에 노출되었을 경우의 행동 절차 최신화
순서
서론
시안화물 노출
신경작용제 노출
질식작용제 노출
수포작용제 노출
무능화작용제
부록 A: 아트로핀/스코폴라민 투여 절차
부록 B: 프랄리독심(2-PAM) 투여 절차
부록 C: 질식작용제 흡입 손상 치료 절차
부록 D: 안구 손상 처치 절차
부록 E: 중증 수포작용제 처치 절차
부록 F: CPG상 오프라벨 사용에 대한 정보
서론
다음은 부상 발생 지점(POI)부터 Role 3 (3단계 처치 지점, TEC/Cold Zone)에 이르기까지의 치료 연속성에서 특정 화학작용제에 대한 의료적 관리에 대한 검토임. 보다 자세한 정보는 '화학 및 생물학적 부상자 현장 관리 핸드북(Field Management of Chemical and Biological Casualties Handbook)'에서 확인할 수 있다.¹
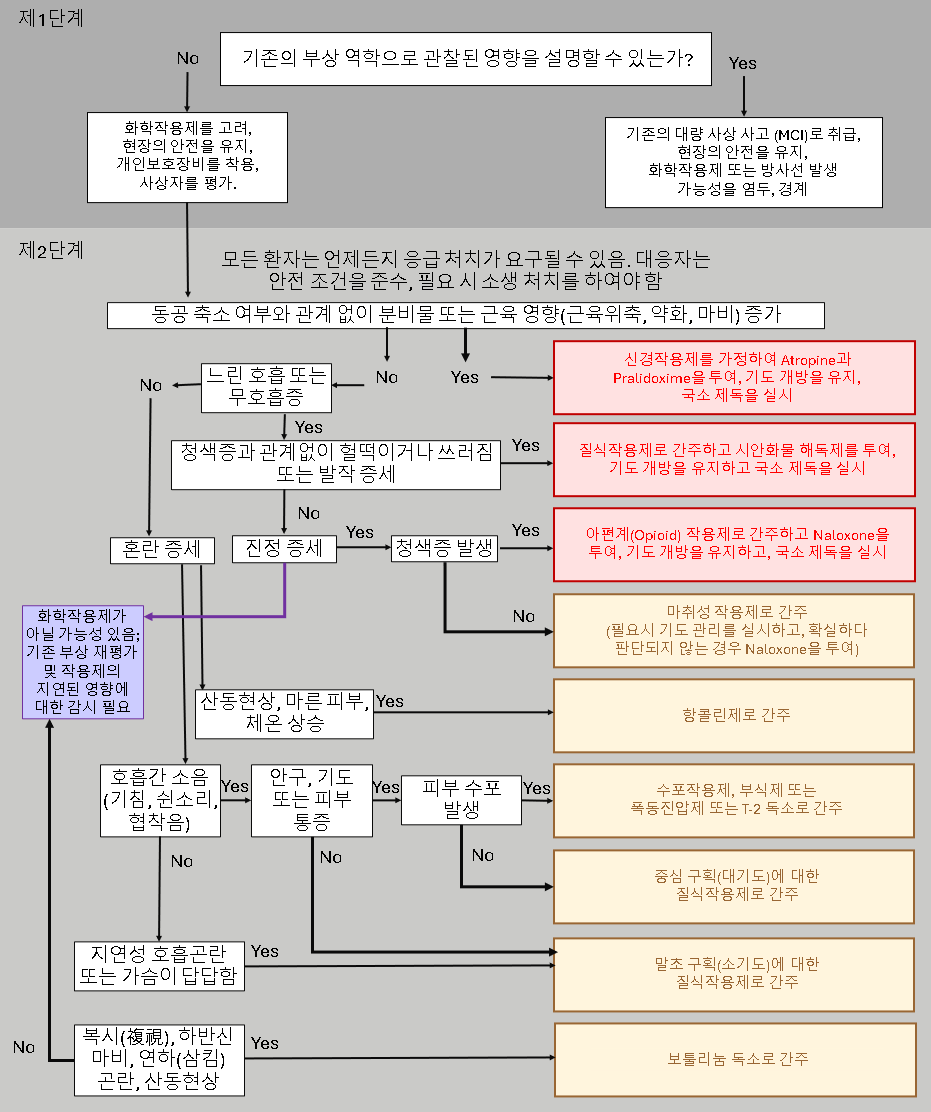
각 작용제 범주에 대한 신속 참조 카드(Rapid Reference Card)가 포함되어 있으며 신속 참조 카드에 포함된 권장 사항에 대한 논의는 아래 본문에 나와 있다. 또한, 아래의 흐름도는 임상 증상에 기반하여 화학전 작용제에 대한 신속한 부상자 분류(Triage, 트리아지)를 수행하는 데 참고할 수 있다. 진단 검사 및/또는 치료 결정은 각 치료 단계에서의 자원 가용성과 전술적 상황에 따라 이루어진다. '전술적전투부상자관리 지침(Tactical Combat Casualty Care Guidelines)'은 'JTS 핵 및 화생방 부상 대응 파트 I: 초기 대응 임상 실무 지침서(JTS Chemical, Biological, Radiological and Nuclear Injury Response Part I: Initial Response Clinical Practice Guideline)'에 설명된 대로 (MARCHE)²를 사용하여 화학물질에 노출된 부상자 치료에 통합되어야 한다.²
[번역] JTS-CPG CBRN Injury Response Part Ⅰ: Initial Response to CBRN Agents
JTS CPG (Joint Trauma System Clinical Practice Guideline, 합동외상체계 임상훈련지침)핵 및 화생방 부상 대응 파트 1: 화생방 작용제에 대한 초기 대응[CPG ID: 69] [최초 출판일: 2018년 5월 1일] 본 지침(CPG)은 해
mtbe.tistory.com
출처: Toxidrome Recognition in Chemical-Weapons Attacks, Ciottone GR. 26 Apr 2018. N Engl J Med 2018; 378:1611-1620
시안화물 노출
배경
시안화물은 역사적으로 드문 전쟁 작용제였으나, 그 치명성과 전 세계적인 가용성으로 인해 현실적이고 잠재적인 테러 작용제로 간주된다. 시안화물은 사린 공격 후 도쿄 지하철에서 발견되었으며3,4, 1993년 세계 무역 센터 폭파물에도 오염물질로 보고되었다.5,6 시안화물은 휘발성이 높고 물에 용해되며 액체 형태인 시안화수소(Hydrogen Cyanide, AC)와 시안화염화물(Cyanogen Chloride, CK)에서 가장 많이 사용된다. 시안화물의 반응성 염(鹽) 형태인 시안화칼륨(Potassium Cyanide), 시안화나트륨(Sodium Cyanide), 시안화칼슘(Calcium Cyanide)도 산업에서 사용되며, 산과 혼합될 때 시안화수소(HCN) 가스를 생성한다. 시안화물은 매우 휘발성이 높아 액체 형태에서 강력한 가스 형태(HCN)로 쉽게 변환된다. HCN은 합성 폴리머의 열분해(Pyrolysis) 과정에서 방출되며 (예를 들어 플라스틱을 태울 때 발생할 수 있고 구조물 화재에서도 방출될 수 있다), HCN은 공기보다 가벼워 개방된 공간에서 빠르게 퍼진다. 반면, 시안화염화물은 공기보다 무거워 더 지속적인 작용제로 작용한다.
징후 및 증상
시안화물은 흡입 노출 후 몇 초에서 몇 분 이내에 증상을 유발할 수 있다. 시안화물은 혈액작용제(Blood agent)로 분류되지만, 초기 증상은 심독성(Cardiotoxicity)과 중추신경계(CNS) 영향으로 작동한다. 초기 증상은 특이성이 없고 일시적일 수 있다. 어지러움(Dizziness), 두통(Headache), 쇠약(Weakness), 발한(Diaphoresis), 그리고 호흡곤란(Dyspnea) 등이 나타날 수 있으며, 이는 광범위한 감별 진단을 필요로 한다. 잘 알려진 쓴 아몬드 냄새는 모든 사람이 감지할 수 있는 신뢰할 만한 징후는 아니다.
진단에 이르는 대표적인 임상 소견은 '청색증 없는 조직 저산소증(Tissue hypoxia without cyanosis)'과 '대사성 산증(Metabolic acidosis)'의 발견입니다. (맥박산소측정기상 정상으로 보일 수 있음.) 신속한 치료가 이루어지지 않으면 환자는 빠르게 혼수(Coma), 혈역학적 불안정(Hemodynamic compromise), 부정맥(Arrhythmias), 경련(Seizures), 2차 심정지(Secondary cardiac arrest)로 진행하며, 결국 사망에 이를 가능성이 높다.
제독
시안화물에 노출된 피해자는 구조자가 보호 장비를 착용하여 안전을 확보한 상태에서 신속히 노출된 장소에서 제거해야 한다. 가스 노출의 경우, 노출된 장소에서 대피하고 모든 의복을 제거하는 것만으로도 대부분의 제독이 이루어진다. 추가적인 제독은 세척 용액(Irrigation solution)을 사용해 진행할 수 있지만, 해독제 투여 치료가 최우선이며 지연되어서는 아니된다.
진단
치료를 용이하게 하기 위해 신속한 진단이 필수적이지만 전술 환경에서는 진단 보조 기기의 가용성이 제한된다. 시안화물 농도는 신속히 확인할 수 없으며, 급성 치료 단계에서는 유용하지 않다. '대사성 산증(Metabolic acidosis)'과 매우 높은 젖산(Lactate) 수치를 보이는 동맥혈 가스(ABG) 결과와 임상 소견을 결합해, 시안화물 노출 가능성을 의심해야 한다. 이러한 진단은 대량 출혈과 저혈량성 쇼크(Hypovolemic shock)를 동반한 외상 상황에서 특히 어렵다. 따라서 높은 수준의 의심과 노출 위험을 시사하는 정보에 대한 인식이 조기 진단의 핵심이 되겠다.
동맥혈과 정맥혈 가스를 동시에 채취하고 산소 함량을 비교하는 것이 도움이 될 수 있다. “정맥혈의 동맥화(Arterialization of venous blood; 두 샘플의 색깔 또는 PaO2가 비슷한 현상)'은 임상적 단서를 보완할 수 있다.
실질적으로 Hot Zone)이나 Warm Zone)에서 처치 제공자가 진단적 지원을 받을 가능성은 낮기 때문에, 치료 결정은 전적으로 임상적 판단에 의존해야 한다. 다행히, 하이드록소코발라민의 이용 가능성 (아래에서 자세히 논의) 덕분에, 이전에 사용되었던 시안화물 해독 키트와 비교했을 때 경험적 해독제 투여의 부작용이 최소화되었다.

치료
치료의 핵심은 하이드록소코발라민을 사용한 해독 치료이다. 보조 치료도 소생(Resuscitation)의 중요한 부분으로, 기도 관리, IV 접근, 심장 모니터링은 시안화물 중독 환자 치료에 도움이 된다. 보조 산소 투여는 해독제의 효능을 높이고, 호흡을 통한 시안화물 배출 및 기타 대사 과정을 촉진하는 데 유용하다.
역사적으로, 시안화물은 '시안화물 해독키트(Cyanide Antidote Kit)'로 치료되어져 왔다. 이 키트는 아밀 니트라이트(Amyl-nitrite), 나트륨 니트라이트(sodium-nitrite), 나트륨 티오황산염(Sodium thiosulfate)으로 구성되어 있다. 그러나 니트라이트는 '메트헤모글로빈혈증(Methemoglobinemia)'을 유발할 수 있으며, 이는 외상을 동반한 환자에게 해로울 수 있다. 현재 선호되는 해독제는 하이드록소코발라민(Cyanokit)이다. 다만, 하이드록소코발라민이 없는 경우, 시안화물 해독 키트를 사용할 수 있다. 아밀 니트라이트 흡입 앰플은 IV / IO 접근이 확보될 때까지 임시 조치로 사용될 수 있다.
하이드록소코발라민(비타민 B12a)은 킬레이트제(Chelating agent)로 작용하며, 시안화물과 결합해 시아노코발라민(비타민 B12)을 형성한다. 시안화물 독성에 대한 하이드록소코발라민의 용량은 다른 치료적 적응증에 비해 훨씬 높으므로, 상업적으로 제조된 하이드록소코발라민을 사용해 최적 용량을 얻는 것이 중요하겠다.
- 권장 용량: 5g IV (소아는 70mg/kg) 15분에 걸쳐 투여
- 추가 투여: 중증 독성 또는 초기 용량에 반응이 없을 경우 반복 투여 가능
하이드록소코발라민은 시안화물로 인한 심정지 상황에서 에피네프린과 동일한 수준으로 효과적이다. 투여 후 몇 주 동안 피부와 소변이 붉게 변색되는 부작용이 있을 수 있지만, 그 외 부작용은 경미하다. Hot Zone이나 Warm Zone)에서 하이드록소코발라민을 투여할지 여부는 IV 또는 IO 접근을 확보하고 주입을 시작하기 위해 중단해야 하는 전술적 위험과 비교하여 신중히 고려해야 한다.
기타 치료 요법 및 예방 조치는 문헌에서 논의되어 있으며, 아래 표에 요약되어 있다.

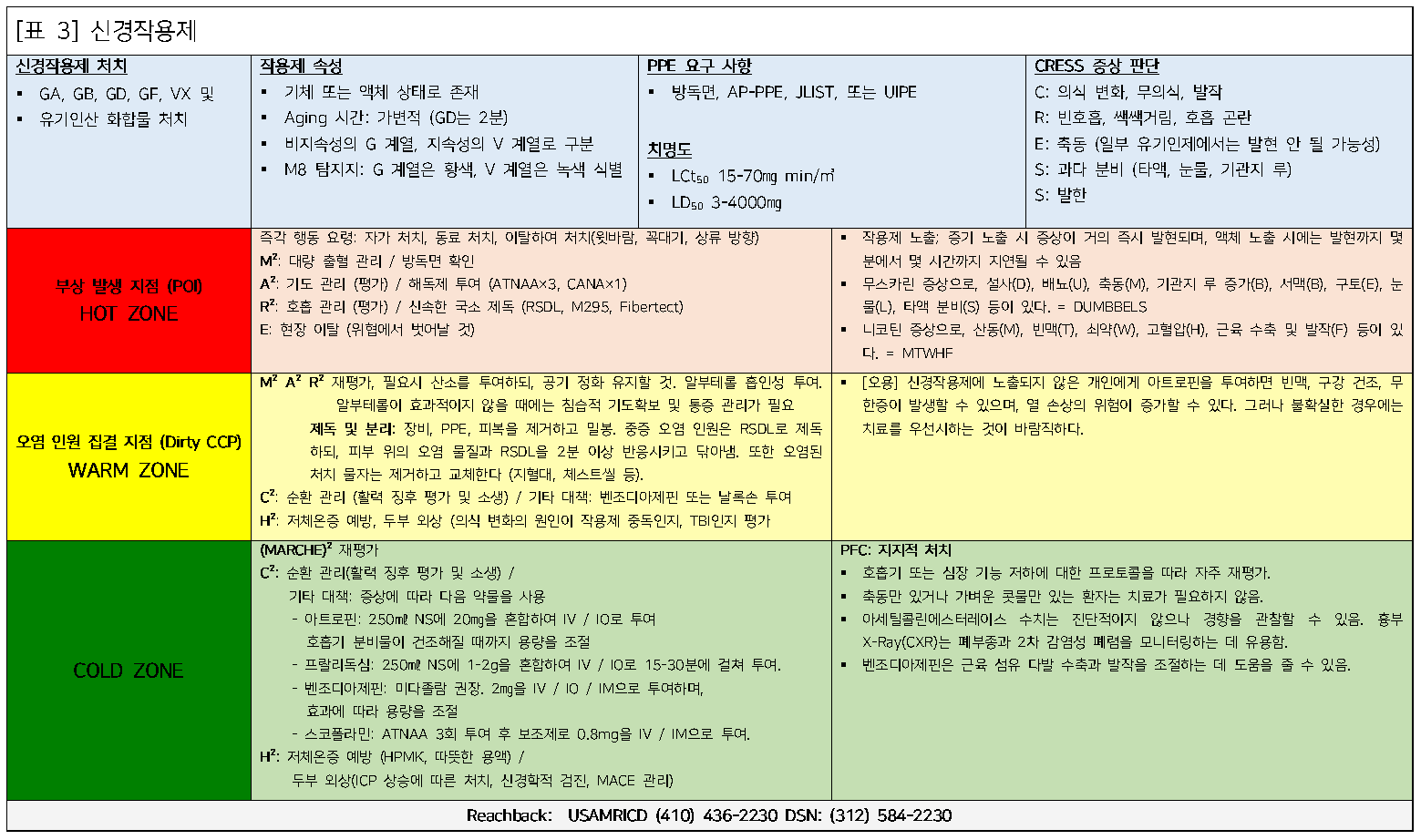
신경작용제 노출
배경
신경작용제 또는 아세틸콜린에스터라제 억제제는 역사상 가장 치명적인 무기로 간주되는 물질 중 일부다. 이러한 물질은 점성이 강한 액체부터 높은 용해도를 가진 기체 형태까지 여러 가지 형태로 존재한다. 이들은 농약으로 사용되는 유기인계 화합물과 화학적으로 유사하며, 이들이 유발하는 증상은 전장에서보다 농업 지역에서 더 자주 발생한다. 가장 치명적인 형태는 반수치사량(LD50)이 1/1000oz (28.3g)에 불과하다.
신경작용제는 주로 V계열과 G계열 두 가지로 나뉩니다. V계열은 점성이 강한 특성을 지니며 여러 방식으로 퍼질 수 있다. 만지거나 섭취하면 매우 위험하지만, 가까운 거리에서 기체 형태로도 증기 위험을 초래할 수 있다. G계열은 실온(약 25℃)에서 액체 상태로 존재하며, 기체 형태로 빠르게 치명적인 흡입 용량을 대량의 사람들에게 노출시킬 수 있는 능력 덕분에 화학 무기로서 매우 효과적이다.
생리학적으로, 신경작용제는 아세틸콜린에스터라제에 결합하여 아세틸콜린의 분해를 억제한다. 신경작용제가 작용하는 두 가지 주요 콜린성 수용체는 무스카린 수용체와 니코틴 수용체다. 무스카린 수용체는 평활근과 분비선에 위치하고 있다. 무스카린 수용체의 과도한 자극으로 인한 증상은 DUMBBELS 기억법으로 기억할 수 있고, 이러한 증상은 아트로핀(Atropine sulfate)으로 대응할 수 있다 (치료 부분에서 논의 예정). 니코틴 수용체는 골격근과 신경절에 위치하고 있으며, 신경작용제가 이 수용체를 자극할 경우 나타나는 증상은 요일의 첫 글자를 사용하여 기억할 수 있다. 프랄리독심(Pralidoxime chloride, 2-PAM) 투여는 콜린에스터라제 활성을 회복시켜, 보통 니코틴 증상을 개선한다.
- DUMBBELS 기억법: 설사(Diarrhea), 배뇨(Urination), 축동(Miosis), 기관지 루 및 수축(Bronchorrhea/Bronchoconstiction), 서맥(Bradycardia), 구토(Emesis), 눈물(Lacrimation), 타액 분비(Salivation)
- MTWTF 요일 기억법 : 산동(Mydriasis), 빈맥(Tarchycardia), 쇠약(Weakness), 고혈압(Hypertension), 근육 수축(Fasciculations)
징후 및 증상
신경작용제 중독은 경증에서 중증까지 다양한 형태로 나타날 수 있으며, 심각한 노출은 신속히 치료하지 않으면 빠르게 사망으로 이어질 수 있다. 몇몇 신경작용제는 아세틸콜린에스터라제에 비가역적으로 결합할 수 있기 때문에 신속한 해독제 치료가 매우 중요하다(예: 소만GD의 비가역적 결합 반감기, 즉 노화 반감기(Aging half-life)는 2분이다).
경미한 노출 영향을 받은 사람의 경우, 안구 보호장비를 착용하지 않았다면 축동이 흔히 관찰된다. 그 외 명백한 무스카린 효과로는 심한 눈물 분비와 과도한 발한, 메스꺼움, 구토가 있으며, 기관지 루 과다분비와 기관지 수축으로 인해 호흡곤란과 숨이 차는 증상이 동반된다. 더 심각한 환자의 경우 이러한 모든 징후와 증상뿐만 아니라 중증 쇠약, 근육 수축, 경련, 의식 상실, 무호흡, 그리고 사망에 이르게 된다.
증상이 나타나는 속도는 노출 경로와 작용제의 용량에 따라 달라진다. 흡입 노출은 증상이 더 빨리 발현되는 경향이 있으며, 신속한 전신 분포로 인해 빠르게 사망에 이를 수 있다. 피부 노출(예: V계열 작용제에 의한 노출)은 지연된 증상 발현을 유발할 수 있다.
제독
대부분의 화학물질과 마찬가지로, 오염 지역에서 노출된 환자를 신속히 제거하여 추가적인 노출과 손상을 방지하는 것이 가장 중요한 단계이다. 기체 노출의 경우, 환자를 해당 지역에서 이동시키고 작용제가 오염되었을 가능성이 있는 모든 의복이나 장비를 신속히 제거해야 한다.
RSDL은 신경작용제의 피부 노출에 대한 가장 효과적인 제독제로 널리 인정받고 있다. RSDL을 사용해 노출된 모든 피부를 가능한 한 빨리 덮는 것은 생명을 구할 수 있는 조치가 될 수 있다. 만약 RSDL이 없을 경우, 0.5% 차아염소산염 용액이나 비누와 물이 대안이 될 수 있다. RSDL이 없다고 해서 제독을 지연해서는 안 된다.
중등도에서 중증(호흡곤란, 경련, 의식 변화)을 보이는 환자의 경우, 제독을 시작하면서 해독제를 즉시 투여해야 한다.
진단
신경작용제 노출의 진단은 임상 증상의 신속한 확인과 탐지 방법을 통한 작용제 식별에 기반한다. 혈청 아세틸콜린에스터라제(AChE) 수치의 실험실 측정은 신경작용제 노출 진단에 유용하지 않다. 이는 수치가 징후, 증상, 또는 예후와 상관관계가 없기 때문이다. 또한, 개인 간 변동성으로 인해 기저 AChE 수치는 유용하지 않다.
치료
신경작용제 해독제로는 2-PAM, 아트로핀, 벤조디아제핀이 포함된다. 신경작용제 독성 치료를 위한 자동 주사기로는 신경작용제 해독 자동 주사기(ATNAA)와 신경성 경련 해독제(CANA)가 있다. ATNAA는 아트로핀과 2-PAM을 포함하고 있으며, CANA는 벤조디아제핀 계열인 디아제팜을 포함한다.
2-PAM
프랄리독심(Pralidoxime chloride, ATNAA 자동주사기 또는 IV / IO)은 아세틸콜린에스터라제와 신경작용제 간 결합을 역전시켜 비가역적 결합을 방지한다. 2-PAM은 자동주사기와 IV 형태로 모두 제공된다. 2-PAM은 아트로핀과의 시너지 효과가 크며(약 30배 효과 증가), 다른 옥심(Oxime)들도 작용제에 따라 다양한 효과를 보이지만, 프랄리독심은 현재 미군 보급체계에 있는 주요 해독제이다.
아트로핀
아트로핀(Atropine sulfate, ATNAA 자동주사기 또는 IV / IO)은 무스카린 효과를 치료하는 데 사용된다. 아트로핀은 기관지 루를 건조시키고, 신경작용제가 유발하는 기관지 수축(bronchoconstriction)을 완화하는 데 도움을 준다. 환자가 경험하는 신경작용제의 양과 증상의 정도에 따라 필요한 아트로핀 용량이 결정된다. 일부 신경작용제(특히 유기인계 화합물) 노출을 완화하기 위해 다량의 아트로핀이 필요할 수 있다.
빈맥은 아트로핀 투여의 금기 사항이 아니며, 이는 호흡곤란으로 인하여 2차 발생할 수 있다. 따라서 생명을 위협하는 기관지 루와 기관지 수축의 역전을 달성하기 위해 아트로핀 치료는 빈맥 상황에서도 적절히 조정되어야 한다.
벤조디아제핀
디아제팜(Diazepam, CANA) 또는 미다졸람(Midazolam)과 같은 벤조디아제핀은 경련 처치의 주요 약물이다. 벤조디아제핀은 니코틴 효과(특히 근육 수축)를 완화하는 데도 도움이 될 수 있다. 최신 연구에 따르면, 미다졸람은 동물 실험에서 가장 효과적인 경련 억제제로 인정되며, 근육주사(IM) 시 가장 빠른 생체이용률을 가진다. 디아제팜은 자동주사기에 포함된 벤조디아제핀으로 효과적이지만, IV 루트가 확보되었거나 자동주사기가 고갈된 경우 다른 벤조디아제핀을 사용하는 것도 적절하다.
용량 및 투여 권장 사항
신경작용제 해독제는 증상의 심각도에 따라 용량을 조정할 수 있다. 하지만 현장에서 노출된 신경작용제의 양과 유형이 불분명한 경우, 노출 의심 환자(단순 축동 제외)에게 ATNAA를 3회, CANA 1회 투여한다. 증상이 이 치료 이후에도 지속되면, 아트로핀 점적 주입(Atropine drip)을 고려해야 한다 (부록 A 참조).
중증 중독의 경우, 3회의 ATNAA 투여 후 추가적인 2-PAM 투여를 고려할 수 있다. 현재 문헌은 용량 조정에 대한 지침이 부족하지만, 전문가 의견에 따르면 500mg IV / IO를 5분에 걸쳐 투여한 후, 10mg/kg/hr의 속도로 주입을 시작해 임상적 개선이 안정될 때까지 유지하는 것이 권장된다. 이는 24시간 이상의 주입이 필요할 수 있다 (부록 B 참조).
예방 요법
피리도스티그민 브로마이드(Pyridostigmine bromide, PB) 예방 요법 처치 결정에서의 '계획적 고려 사항과 위험 대 이익 분석'은 본 CPG의 범위를 벗어난다. 그러나 처치 제공자는 피리도스티그민 예방요법을 받은 환자들이 경험하는 임상적 영향과 사전 치료가 임상적 징후와 치료 반응에 미치는 영향을 이해하는 것이 중요하다.
피리도스티그민(30mg 정제)은 소만(GD) 노출에 대한 사전 치료로 FDA의 승인을 받았으며, 이는 동물 실험에서 2PAM 및 아트로핀 치료와 함께 사용할 때 소만 치사율을 감소시키는 효과에 기반한다(FDA 피리도스티그민 브로마이드 제품 설명서 참조). 그러나 인간 대상 연구 사례는 없다.
피리도스티그민은 말초 아세틸콜린에스터라제의 일부(20-40%)를 억제함으로써 작용한다. 이는 혈뇌 장벽을 쉽게 통과하지 않으므로 중추 억제 효과를 유발하지 않는다. 따라서 피리도스티그민 예방요법의 부작용은 일반적으로 경미한 콜린성 또는 니코틴성 증상(설사, 복통, 월경곤란증이 자원자들에서 가장 흔한 부작용으로 보고됨)으로 나타난다. 피리도스티그민과 말라리아 예방약인 메플로퀸(Mefloquine)을 함께 복용하면 위장관 작용이 더해져 설사가 증가할 수 있다. 오피오이드(아편)계 서맥은 피리도스티그민과 함께 사용하는 경우 악화할 수 있다. 피리도스티그민은 탈분극성 신경근 차단제(Succinylcholine)의 활성도를 강화할 수는 있으나, 비탈분극성 신경근 차단제에는 보다 다량 필요할 수도 있다. 피리도스티그민 예방 요법을 받은 환자들의 신경작용제 독성 치료는 일반적인 신경작용제 독성 치료와 동일하다.

질식작용제 노출
배경
폐 손상 작용제(Pulmonary agents, 독성 산업 화학물질 및 질식작용제라고도 불림)는 현대 화학전의 선구자로 역사적 중요성을 가지며, 그 용이한 입수 가능성으로 인해 오늘날에도 주요 화학적 위협으로 여겨진다. 염소(Chlorine)와 포스겐(Phosgene)은 전 세계적으로 대량으로 생산 및 저장되고 있으며, 기화될 경우 치명적인 피해를 유발할 수 있다. 암모니아, 황화수소, 산화아연, 인 연기, 테플론의 부산물인 과불화이소부틸렌(Perfluoroisobutylene)과 같은 다른 물질들도 화학적 폐 손상을 유발할 수 있지만, 이들은 화학 공격에 사용될 가능성은 낮다.
염소는 -34℃에서 기체가 되어 압축된 액체 형태로 저장된다. 포스겐은 8.3℃에서 독성 기체가 된다. 두 가스가 유발하는 손상의 정도는 노출 시간과 농도에 따라 달라진다. 이 외에도 호흡 속도와 깊이(분당 환기량), 그리고 가능하다면 신체 자세도 독성에 영향을 미칠 수 있다.
염소 노출은 30ppm에서 기침을 유발하며, 40-60ppm 이상의 농도로 30분 이상 노출되면 폐에 심각한 손상을 초래한다. 포스겐은 더욱 은밀하게 작용하며, 0.4ppm의 냄새 감지 한계치보다 낮은 농도에서도 장기간 노출 시 독성을 나타낼 수 있다. 또한, 후각 피로가 발생할 수 있어 경고 냄새를 일시적으로만 감지할 가능성이 있다. 포스겐의 IDHL은 2ppm인 반면, 염소의 IDHL은 100ppm이다. 두 가스 모두 호흡기 내 수분과 반응하여 가수분해를 겪는다.
염소는 염화수소산과 차아염소산을 형성하며, 이는 시스테인의 설프하이드릴기와 반응해 효소 억제를 유발한다. 또한, 염소의 가수분해는 자유 라디칼을 생성하여 직접적인 세포 손상과 사망으로 이어질 수 있다. 포스겐은 물과 반응하여 이산화탄소와 염화수소를 생성한다. 그러나 포스겐의 주요 독성은 아실화(Acylation)로 발생하며, 이 과정에서 포스겐이 설프하이드릴기, 아민기, 하이드록실기와 상호작용하여 단백질 및 지질 변성, 막 구조 손상, 효소 기능 간섭을 유발한다. 포스겐은 또한 폐의 계면활성층을 파괴한다.
징후 및 증상
두 가스 모두 밀폐된 공간에서 산소를 대체하여 질식을 유발할 수 있다. 그러나 더 일반적으로는 자극제 역할을 하여 기전 설명에서 언급한 방식으로 호흡기에 손상을 준다. 또한, 이들 가스는 전신 염증 반응을 유발할 수 있다.
염소는 불쾌한 냄새를 가지며 강한 자극성을 보인다. 염소는 점막과 접촉했을 때 더 빠르게 가수분해되기 때문에, 눈, 입, 상기도와 같은 습한 부위에서 즉각적인 증상을 유발한다. 일반적인 증상으로는 눈 통증, 눈꺼풀 경련(Blepharospasm), 눈물 분비가 있으며, 그 외에 두통, 타액 분비, 호흡곤란, 기침, 객혈, 가슴 작열감, 구토가 나타날 수 있다.
진찰 간 빈맥, 빈호흡, 때로는 청색증이 관찰될 수 있다. 눈 자극이 있는 경우, 형광염료를 이용한 눈 각막 화상/찰과상 검사가 필요하다. 구강인두 발적이 있는 경우, 더 심각한 하부 기도 손상이 있을 가능성이 있어 기도 평가가 필요하다. 천명 (Stridor), 쉰 목소리 (Hoarseness), 발성 불능 (Aphonia)은 후두 부종 (Laryngeal edema) 또는 후두경련 (Laryngospasm)을 시사하는 것일 수 있다. 또한 구강인두 분비물이 과도하게 나타날 수 있다.
포스겐은 갓 깎은 건초 냄새가 난다. 더 은밀하게 작용하며 초기 증상이 경미하거나 없는 경우도 있다. 포스겐 노출에 의한 전형적인 증상 발현은 노출 후 2-6시간에 나타나며, 지연된 증상은 노출 후 최대 15시간까지 보고된 바 있다. 포스겐의 주요 영향은 말초 기도에 나타나기 때문에, 호흡곤란, 가슴 답답함 또는 통증, 기침이 흔한 증상이다. 저산소증(Hypoxia)과 폐부종(Pulmonary edema)이 증상 발현 몇 시간 후에 나타날 수 있다. 폐부종으로 인한 체액 이동은 저혈량증(Hypovolemia)을 유발할 수 있다. 폐부종이 조기 발현된 경우, 이는 심각한 예후를 암시한다.
제독
염소 또는 포스겐에 노출된 경우, 독성 가스로부터 안전하게 제거하는 것이 최우선이다. 잠재적 노출 지역에서 구조자와 제공자를 위한 호흡기 보호는 필수적이다. 환자를 노출 지역에서 제거한 후, 모든 의복을 제거하여 제독을 계속해야 한다. 독성 가스 노출의 경우, 이는 가스로 인한 대부분의 위험을 제거한다. 비누와 물만으로도 제독을 완료하는 데 충분하다.
진단
폐 손상 유발제 독성을 확인하거나 정량화할 수 있는 진단 검사는 현재 사용 가능하지 않다. 동맥혈 가스 검사(ABG)와 흉부 X선(CXR)과 같은 표준 검사는 필요한 경우 보조적 치료를 안내하는 데 사용될 수 있다. 동맥혈 가스 검사는 산소화 상태를 추적하는 데 유용할 수 있으나, 포스겐 노출 초기 단계에서는 정상일 수 있다. PCO2는 폐쇄성 병리 생리학이 있는 환자에서 상승할 수 있으며, 이는 기관지 확장제 또는 코르티코스테로이드 사용의 필요성을 나타낼 수 있다.
동맥혈 가스 검사와 유사하게, 노출 직후 시행된 흉부 X선은 정상으로 보일 수 있으나, 몇 시간 이내에 뚜렷한 폐부종으로 진행할 수 있다. 다행히 흉부 X선은 임상 검사 소견보다 폐부종을 먼저 감지할 수 있다. 초기 미세한 폐부종 소견을 감지하려 할 때, 기준선 흉부 X선이 비교에 유용할 수 있다. 만약 8시간 후 흉부 X선이 정상이라면, 환자가 폐부종을 발병할 가능성은 낮다.

치료
염소 노출은 노출 직후 과도한 분비물과 후두경련을 유발할 수 있으므로, 제공자는 기도 관리와 응급 외과적 기도 확보를 준비해야 한다. 반면, 포스겐에 노출된 환자는 증상이 없더라도 환자로 간주하여 관리해야 한다. 이러한 환자는 운동을 피하고 안정을 유지해야 하며, 운동은 포스겐 노출 환자에서 폐부종과 더 나쁜 결과를 초래할 수 있다. 고급 기도가 삽입된 경우, 대구경 기관 내 튜브는 독성 가스 노출로 인해 점막이 벗겨지고 기도에 잔여물이 쌓이는 상황에서 폐 배액 관리를 용이하게 한다.
정맥 주사액은 체액 부족 상황에서 필요할 수 있으나, 경험적으로 투여해서는 안 된다. 체액 과잉은 폐부종을 악화시킬 수 있으므로 피해야 한다. 후두경 검사 또는 기관지경 검사가 필요할 수 있으며, 기도 손상이 발생할 경우를 대비해 고급 기도 관리 준비를 갖추어야 한다. 간소화된 자동 설정을 가진 휴대용 인공호흡기(SAVe ventilator)는 이러한 환자의 환기 관리를 위해 충분하지 않을 수 있다. '폐부종, 기관지경련, 급성호흡곤란증후군(ARDS)'의 위험성과 관련하여, 인공호흡기 설정을 조정할 수 있는 능력이 매우 중요하다. 또한, 흡인 장치는 기도 개방 유지를 위한 핵심 요소로, 전구 흡인만으로는 충분하지 않으며, 인라인 흡인이 가능한 기계적 흡인 장치가 선호된다.
고급 중재 및 관련 증거는 아래 표에 설명되어 있다. 가용한 증거의 대부분은 동물 연구에 기반하며, 인간 데이터를 통해 확보된 정보는 제한적이다.

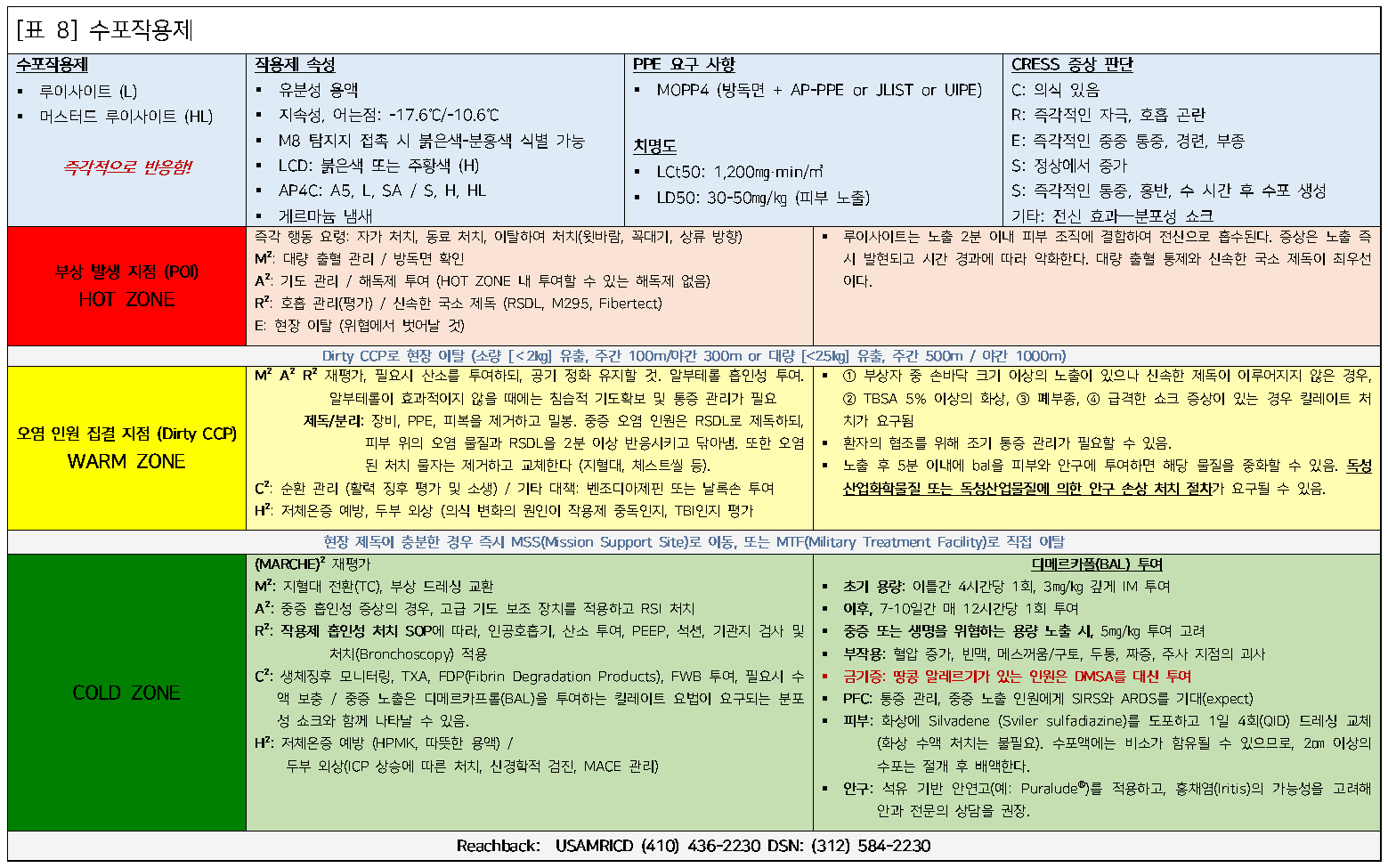
수포작용제 노출
배경
수포제는 제1차 세계대전 동안 화학전 무기로 개발 및 사용되었다. 이 물질은 액체, 고체, 기체 등 여러 형태로 사용할 수 있으며, 일반적으로 황 머스터드(Sulfur mustard), 질소 머스터드(Nitrogen mustard), 루이사이트(Lewisite)로 구분된다. 이 중 황 머스터드는 다양한 농도와 형태로 사용되며, 현재 전장에서 가장 일반적으로 사용되는 수포제이다.
황 머스터드는 다음과 같은 세 가지 주요 형태로 구분된다: HD는 증류된 순수 황 머스터드(약 100% 순도)로, 투명하고 마늘 냄새가 난다. H는 증류되지 않은 황 머스터드로, 화학 혼합물에 따라 투명, 노란색, 적갈색 또는 검은색을 띤다. HT는 HD와 T(점증제)가 혼합된 형태이다.
최근 분쟁(예: ISIS와의 충돌)에서는 H 황 머스터드가 사용되었으며, 조잡한 화학 실험실에서 제조된 점성이 강한 검은 물질로, 저장 후 2-3주 내에 분해되어 사용이 어려워진다.
질소 머스터드는 화학전 무기로 사용된 사례가 훨씬 드물며, N-1, N-2, N-3의 세 가지 형태로 나뉜다. 각각의 냄새는 N-1은 생선, N-2는 과일, N-3는 쓴 아몬드와 비슷하다. 질소 머스터드는 투명-노란색의 점성이 강한 물질로, 증발이 느리며 부상자의 접촉이나 가스 방출로 구조자를 해칠 수 있다. 이 물질은 항암제나 사마귀 제거제로 의료 목적으로 사용되었으며, 전장에서는 사용된 적이 없다.
루이사이트는 이 화학 물질군의 마지막 수포제로, 비소 기반이며 순수 상태에서는 투명한 액체이고, 불순물 상태에서는 호박색 또는 검은색이다. 다른 수포제처럼 피부, 눈, 호흡기를 심하게 자극하며, HD와 혼합되어 더욱 강력한 화학 무기로 사용될 수 있다. 루이사이트는 다른 수포제와 달리, 전신 효과를 상쇄할 수 있는 해독제가 있는 유일한 수포작용제이다.
징후 및 증상
모든 수포제의 가장 일반적인 노출 경로는 피부이다. 황 머스터드는 피부 또는 점막과 접촉한 후 몇 시간 내에 수포를 동반한 화학 화상을 유발한다. 접촉 직후에는 증상이 나타나지 않지만, 황 머스터드는 접촉 후 몇 분 내에 피부나 눈 점막을 통해 흡수된다. 2도 및 3도 화상은 노출 후 2-10시간에 걸쳐 눈과 피부에서 발생하며, 극심한 통증, 각막 천공, 눈의 침식, 피부의 광범위한 수포화를 초래한다. HD는 제1차 세계대전 당시 2-3%의 사망률을 보였으나, TBSA 25% 이상이 화상을 입으면 치명적일 수 있다. 질소 머스터드도 황 머스터드와 유사한 피부 및 눈 손상을 유발한다. 반면, 루이사이트는 피부 및 눈에 즉각적인 통증과 자극을 유발하며, HD나 질소 머스터드보다 훨씬 빠르게 수포를 형성한다.
흡입 또는 섭취 시에도 유사한 문제가 발생하며, 호흡기 및 소화기 점막 손상과 심각한 화상을 초래한다. 액체 형태의 물질이 기체 형태보다 더 심각한 손상을 유발한다. 피부와 눈의 노출과 마찬가지로, HD의 흡입은 호흡기계에서 지연된 효과를 일으켜, 노출 후 몇 시간 내에 기관지 경련과 부종을 유발한다. 반면, 루이사이트는 몇 초에서 몇 분 이내에 호흡기 증상을 유발하며, 이후 폐부종으로 빠르게 진행된다.
모든 수포제는 노출 경로와 용량에 따라 여러 지연된 효과를 유발할 수 있다. 골수 억제로 인해 감염 가능성이 증가할 수 있으며, 질소 머스터드는 빈혈을 초래한다. 고용량의 황 머스터드는 경련과 과흥분을 유발할 수 있다. 고용량의 루이사이트는 간 괴사, 급성 신부전, 모세혈관 누출로 인한 쇼크(루이사이트 쇼크)를 유발할 수 있다. 장기적으로는 악성종양, 각막 흉터, 만성 호흡기 질환, 피부 흉터와 같은 효과가 의심되고 있다.
제독
머스터드에 노출된 환자를 처리할 때, 구조자와 의료 제공자의 안전이 가장 중요한 초기 단계이다. 초기 치료 시 구조자는 호흡기와 피부 보호구를 착용해야 한다. 손 보호를 위해 부틸 고무가 권장되며, 이중으로 착용한 니트릴 장갑도 노출로부터 보호할 수 있다. 증상의 지연 발현으로 인해 오염된 환자가 무해해 보일 수 있으나, 적절히 보호되지 않으면 폐, 눈, 피부에 심각한 손상을 입을 수 있다. 환자는 반드시 제독을 받고 모든 의복과 장비를 제거해야 한다. 수포제는 몇 분 내에 체내로 흡수되지만, 노출 후 며칠 동안 장비나 의복에 잔류할 수 있다.
제독은 흡수를 줄이기 위해 3-5분 이내에 이루어져야 한다. 건조한 천으로 화학 물질을 피부에서 제거하는 것이 첫 단계이며, 이후 RSDL을 사용해야 한다. 수포제는 신경작용제와 달리 해독제가 없으므로, 초기 치료는 빠른 제독에 중점을 둔다. 눈 노출은 피부보다 흡수가 더 빠르므로, 즉시 물로 세척하여 영향을 최소화해야 한다. Morgan Lens가 포함된 세척 키트는 눈 제독을 용이하게 할 수 있다. 섭취가 의심되는 경우, 구토를 유도해서는 안 되며, 활성탄도 효과적이지 않다. 제독 후에는 표준 화상 치료가 피부 손상에 권장된다. 체액 대체는 일반적인 열 화상 예상치와 다를 수 있으나, 소변 배출량(시간당 30-50ml)이 적절한 체액 보충의 지표로 사용될 수 있다.
화학적으로 오염된 상처는 적극적으로 세척하고, 심각한 오염이 있는 것처럼 취급해야 한다. 머스터드는 노출 후 즉시 개방된 상처나 점막을 통해 전신으로 흡수된다. 초기 제독 후, 환자는 병원으로 이송되어 전신적 및 국소적 효과를 관찰해야 한다. 오염된 상처는 거의 항상 외과적 변연절제술이 필요하다.
진단
수포제 노출을 확인할 수 있는, '즉시 사용 가능한 검사'는 존재하지 않는다. 백혈구 증가증은 노출된 첫날 발생할 것으로 예상되며, 손상 정도에 따라 백혈구 수가 증가한다. 이후 골수 억제가 발생하여 3-5일경 백혈구 수치가 감소하고, 9일경 최저점에 도달한다. 백혈구 수치가 500 미만인 경우 예후가 좋지 않음을 나타낸다. 흉부 X선은 폐렴 여부를 모니터링하는 데 사용될 수 있으며, 폐렴은 일반적으로 노출 후 2~3일 내에 나타난다.
치료
황 머스터드와 질소 머스터드에 노출된 무증상 환자는 피부, 눈, 폐의 증상이 지연될 수 있으므로, 6-10시간 동안 잠재적 노출 여부를 관찰하는 것이 권장된다.
눈에 노출된 환자는 항콜린성 안과용 연고를 정기적으로 적용하여 유착(Synechiae) 형성을 예방할 수 있다. 항생제와 스테로이드 연고는 1-2시간마다 적용하고, 신속히 안과 전문의에게 의뢰해야 한다. 연고를 눈꺼풀에 바르면 서로 달라붙는 것을 방지하고, 감염이나 고름 배출을 도울 수 있다. 눈꺼풀 경련(Blepharospasm)은 국소 마취제로 치료하여 안구 검사를 용이하게 하고, 지속적인 눈 통증에는 전신 진통제를 투여해야 한다.

노출 후 몇 시간 뒤 호흡기 증상이 나타나는 환자는 화학 폐렴으로 간주하여 치료해야 하며, 알부테롤을 적극적으로 사용하고, 알부테롤에 반응하지 않는 경우 조기 침습적 기도 관리를 고려해야 한다. 알부테롤 효과가 없을 경우 전신 스테로이드 사용이 권장되지만, 추가적인 면역 억제는 권장되지 않을 수 있다. 흡입용 탄산수소나트륨은 가능성 있는 치료법으로 제안되었지만, 이를 뒷받침하는 강력한 증거는 부족하다. 항산화제와 청소제(예: 티오황산나트륨)는 동물 연구에서 일부 효과를 보였으나, 인간 데이터를 기반으로 한 근거는 없다. 이러한 치료법은 보조적 치료에 반응하지 않는 환자에게만, 입증되지 않은 치료의 잠재적 이점이 위험을 초과할 때 고려해야 한다.
골수 억제는 보통 9-10일경에 최고조에 달한다. 호중구 집락 자극 인자(G-CSF) 유사체를 투여할 수 있으며, 심각한 골수 억제는 골수 이식의 적응증이 될 수 있다.
루이사이트의 해독제는 British Anti-Lewisite (BAL)로, 디메르카프롤(Dimercaprol)이라고도 한다. BAL은 병원 환경에서만 사용해야 하며, IM로 투여된다. BAL은 킬레이트제로 작용하지만, 급성 신부전과 기타 심각한 부작용 가능성으로 인해 중증 호흡기 증상이나 루이사이트 쇼크가 있는 환자에게만 권장된다.
무능화작용제 노출
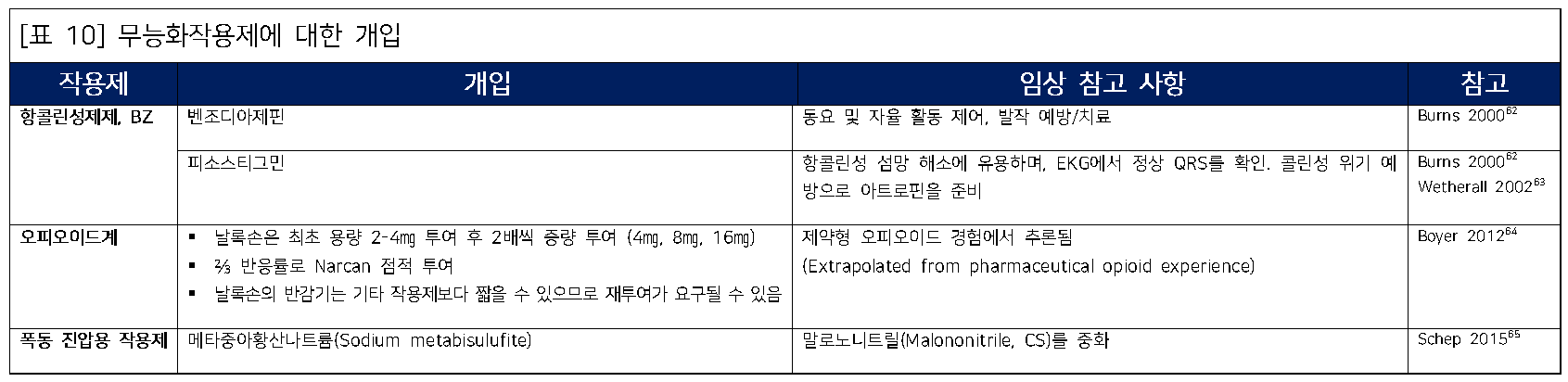
배경
무력화 작용제는 일시적인 신체적 및/또는 정신적 영향을 유발하여 대상자가 현재의 임무나 활동을 계속할 수 없게 만든다. 종종 비치명적 작용제로 설명되지만, 충분히 높은 용량으로 투여될 경우 사망이나 심각한 질병을 초래할 수 있다. 무력화 작용제는 일반적으로 세 가지 범주로 나뉜다:
- 항콜린제
- BZ(3-quinuclidinyl benzilate)는 전형적인 항콜린제이며, 이외에도 전쟁을 위해 개발될 수 있는 항콜린제가 있다. 영국은 Agent 15로 알려진 유사한 물질을 보유한 것으로 전해진다. BZ는 원래 위장관 경련 완화제로 개발되었으나, 심각한 중추신경계 부작용으로 인해 의약품으로는 폐기되었다. 무력화 작용제로서 BZ는 아트로핀에 비해 말초 항무스카린 효과가 상대적으로 낮아 매우 높은 안전성을 가진다. 유효 무능화 용량은 0.5㎎이며, 일반적으로 에어로졸이나 발연 탄약으로 분산된다.
- 진정제
- 오피오이드와 휘발성 마취제는 모두 진정 또는 안정 효과를 가진 잠재적 무력화 작용제이다. 펜타닐은 모르핀보다 100배 더 강력한 합성 오피오이드로, 새로운 파생물이 지속적으로 개발되고 있다. 예로 카르펜타닐은 펜타닐보다 100배 더 강력하다. 이러한 작용제는 개별적으로는 매우 효과적이지만, 이를 에어로졸화하여 무력화 작용제로 사용하는 데는 문제가 있을 수 있다. 특히 군중 속에서 흡수가 변동될 가능성이 크다.
- 폭동진압작용제
- 폭동진압작용제는 Harassing Agent로도 알려져 있으며, 눈물, 점막 자극, 심한 기침, 구토 등 불편함과 자극을 유발한다. 대표적인 작용제로는 클로로아세토페논(CN, Mace), 클로로벤질리덴 말로노나이트릴(CS), 올레오레진 캡시쿰(OC, 페퍼 스프레이), 디페닐아미노클로로아르신(DM, 아담사이트) 등이 있다. CN은 다른 작용제보다 해로운 특성을 가지며, 낮은 LCt50를 가진다. DM은 주로 구토를 유발한다.

징후 및 증상
- 항콜린제
- BZ는 중추신경계(CNS) 효과를 목표로 하기 때문에, 주요 증상은 항콜린성 섬망으로 나타나며 말초 증상은 적게 나타난다. 환자는 섬망으로 인해 명확한 병력을 제공하지 못하는 경우가 많다. 섬망은 가변적일 수 있으며, 경미한 장애에서 혼수상태까지 범위가 다양하다. 환각, 심한 초조감, 발작 등이 발생할 수 있다.
- 흔히 묘사되는 말초 증상으로는 "뼈처럼 건조하고(dry as a bone), 토끼처럼 뜨겁고(hot as a hare), 비트처럼 붉고(red as a beet), 박쥐처럼 눈이 멀다(blind as a bat)"는 표현이 있으나, 이는 가변적이거나 지연될 수 있다.
- 진정제
- 오피오이드 유도체 진정제는 전형적인 오피오이드 중독 증후군으로 나타날 수 있다. 이는 동공 축소, 중추신경 억제, 호흡 억제를 포함한다. 서맥, 저혈압, 저체온증이 발생할 수 있으며, 이는 용량 의존적으로 오피오이드 혼수 상태로 진행되면서 2차적으로 나타날 수 있다.
- 폭동 진압제
- 폭동 진압제는 피부, 호흡기, 눈에 영향을 미칠 수 있다. 안구 증상에는 통증, 눈물 분비, 안검경련 등이 포함된다. 호흡기 증상은 점막 자극에서 심한 호흡곤란, 기침, 흉부 압박감까지 다양하다. 특히 기관지 경련이 흔하며, 기저 반응성 기도 질환이 있는 경우 심각할 수 있다. 분비물의 경우 다량의 콧물과 타액 분비가 발생할 수 있으며, 이는 신경작용제 노출의 가능성을 배제하기 위해 임상적 주의가 필요하다. 또한 피부 통증과 작열감이 일반적이나, 고용량에서는 수포가 발생할 수 있다.
일반적 관리
노출로부터 안전하게 제거하는 것이 최우선이다. 노출 가능 구역에서 의료 제공자를 위한 호흡 보호 장비는 필수적이다. 환자를 노출 구역에서 제거한 후, 모든 의복과 개인 물품을 제거하며 제독 작업을 계속할 수 있다. 단순한 비누와 충분한 물로도 철저한 제독이 가능하다. 폭동 진압제에 의해 발생한 증상의 개선은 제독 후 일시적일 수 있음을 인지해야 한다. 모든 무력화 작용제의 의료 관리는 주로 증상 완화에 중점을 두며, 환자의 증상에 맞추어 치료를 조정하는 것이 중요하다.
항콜린제 중독 관리
임상 증상의 관점에서 항콜린제 중독 환자는 구강 건조와 빈맥을 보여 탈수로 오인될 수 있으나, 실제로는 체액의 상태(euvolemic)는 정상인 경우가 많다. 그러나 정신운동으로 동요와 고체온증이 흔하므로, 심부 체온, 체액 상태, 소변 배출량을 면밀히 모니터링해야 한다. 고체온증이 있는 경우 즉각적인 냉각 치료가 필요하다.
약물 치료에는 섬망과 동요 증세를 조절하는 것이 포함된다. 동요 증세는 효과에 맞게 적정된 벤조디아제핀으로 안전하게 조절할 수 있다. 종종 동요 증세를 조절하면 빈맥과 고체온증도 개선된다. 피소스티그민은 섬망을 관리하기 위한 또 다른 옵션이다. 이는 혈뇌장벽을 통과하는 3급 아민이다. 피소스티그민을 사용하기 전에, 삼환계 항우울제(TCA)와 같은 나트륨 통로 차단제의 존재를 배제하는 것이 중요하다. 피소스티그민을 사용하기 전에, QRS 간격이 100msec 미만인지 확인하기 위해 EKG를 시행해야 하며, 이는 EKG를 즉시 사용할 수 없는 경우 피소스티그민의 활용도를 제한한다. 또한, 기도에 영향을 미칠 수 있는 콜린작용 반응에 대비하여 아트로핀을 준비해야 한다. 대부분의 경우, 벤조디아제핀이 주요 치료 옵션으로 간주되며, 이는 거의 모든 환자에게 안전하게 투여할 수 있다.
진정제 관리
호흡기계 지원이 진정제와 관련된 오피오이드 중독 치료의 주요 초점이다. 날록손(Naloxone)은 선택적 해독제로, 호흡 억제를 역전시키기 위해 적정하여 투여해야 한다. 비강용 날록손은 정맥 접근 없이도 신속하게 투여할 수 있다. 날록손은 효과에 맞게 적정하여 사용해야 한다. 초기 용량으로 2-4mg이 적절하지만, 합성 오피오이드의 효과를 역전시키기 위해서는 훨씬 더 높은 용량이 필요할 수 있다. 날록손의 반감기가 원인 물질의 반감기보다 짧을 수 있으므로, 반복 투여나 날록손 점적 투여가 필요할 수 있다.
폭동진압작용제
대부분의 진압제는 작용 시간이 짧으며, 대증 치료만으로도 증상이 가라앉을 때까지 충분하다.
진단
실험실 검사 값은 진단에 거의 도움이 되지 않는다. 오피오이드는 일반적인 독소 검사에서 검출될 수 있다.
치료
고급 중재와 이를 뒷받침하는 근거는 아래 표에 설명되어 있다.
약어의 정의
| 약어 | 영문 뜻 | 한글 뜻 |
| ACLS | Advanced Cardiac Life Support | 전문심장소생술 |
| AP4C | Handheld Chemical Decontamination Device | 휴대용화학제독장비. (AP4C는 화학작용제탐지장비인데..?) |
| AP-PPE | All-purpose Personal Protective Ensemble | 다목적개인보호장구 |
| ARDS | Acute Respiratory Distress Syndrome | 급성호흡곤란증후군 |
| CANA | Convulsive Antidote Nerve Agent | 신경 경련 해독제 (MARK-1과는 다름) |
| CCP | Casualty Collection Point | 사상자 집결 지점 |
| Cl | Chlorine | 염소 |
| COCl2 | Phosgene | 포스겐 |
| CRESS | Consciousness, Respirations, Eyes, Secretions, Skin | 의식, 호흡, 안구 손상, 분비물, 피부 등의 상태를 살펴 화학 오염여부를 신속 판단하는 방법 |
| CWA | Chemical Warfare Agents | 화학전 작용제; 화학작용제 (화학무기) |
| DMSA | Dimercaptosuccinic Acid | 디메르캅토호박산 (C₄H₆O₄S₂) |
| FDP | Freeze-dried Plasma | 동결 건조 혈장 |
| FWB | Fresh Whole Blood | 신선 전혈 |
| HPMK | Hypothermia Management Kit | 저체온증 예방 및 관리 키트 |
| ICP | Intracerebral Pressure | 두개내압 |
| IDLH | Immediately Dangerous to Life or Health | 생명에 즉각적인 위험 |
| JLIST | Joint Lightweight Integrated Suit Technology | 합동경량보호의 (미 해병에서 채용) |
| LCD | Lightweight Chemical Detector | 경량 화학작용제 탐지기 |
| LCt50 | Lethal Concentration, 50% | 반수 치사량, 반수 치사 농도 |
| LD50 | Lethal Dose, 50% | 반수 치사량; 반수 치사 용량 |
| MDI | Metered Dose Inhaler | 계량 흡입기 |
| MACE | Military Acute Concussion Evaluation | 군 급성 뇌진탕 평가 |
| MOPP | Mission Oriented Protective Posture | 임무형 보호 태세 |
| MSS | Mission Support Site | 임무 지속지원 지점 |
| NS | Normal Saline | 생리식염수 |
| PEEP | Positive End Expiratory Pressure | 호기말 양압 |
| PFC | Prolonged Field Care | 지연된 현장 처치 |
| PPE | Personal Protective Equipment | 개인보호장비; 보호의 |
| RSDL | Reactive Skin Decontaminant Lotion | 반응형 피부 제독 로션 |
| SIRS | Systemic Inflammatory Response Syndrome | 전신염증반응증후군 |
| TBI | Traumatic Brain Injury | 외상성 뇌손상 |
| TIC | Toxic Industrial Chemical | 독성 산업 화학 물질 |
| TIM | Toxic Industrial Material | 독성 산업 물질 |
| TXA | Tranexamic Acid | 트라넥삼산, 트라넥사민산 |
| UIPE | Undergarment Integrated Protective Ensemble | 이거 ↓ |
| USARMICD | US Army Medical Research Institute of Chemical Defense | 미 육군 화생방방호의학연구소 |
참고자료
- Field Management of Chemical and Biological Casualties Handbook. Garr JH, ed. 2016, Borden Instutute, Office of the Surgeon General, Falls Church, VA. Available at:
- Joint Trauma System, Chemical, Biological, Radiological and Nuclear Injury Response Part I: Initial Response Clinical Practice Guideline, 01 May 2018.
- Suzuki T, Morita H, Ono K,.et al. Sarin poisoning in Tokyo subway. The Lancet. 1995;345(8962) 1446-1447
- Okumura T, Taskasu N, Ishimatsu S, et al. Report on 640 victims of the Tokyo subway sarin attack. Annals of Emergency Medicine. 1996;28(2): 129-35.
- Baskin SL, Kelly JB, Maliner BL, et al. Cyanide poisoning. In: Medical aspects of chemical and biological warfare. Washington D.C.: Office of the Surgeon General; 2008: 371-410.
- Parachini JV. The World Trade Center bombers (1993). In: Tucker JB, ed. Toxic Terror: Assessing Terrorist Use of Chemical and Biological Weapons. Cambridge, MA: MIT Press; 2000: 185-206
- Baud FJ, Borron SW, Mégarbane B, et al. Value of lactic acidosis in the assessment of the severity of acute cyanide poisoning. Crit Care Med. 2002 Sep;30(9):2044-50.
- Sauer SW, Keim ME. Hydroxocobalamin: improved public health readiness for cyanide disasters. Annals of Emergency Medicine. 2001;37(6): 155-68.
- Bebarta VS, Tanen DA, Lairet J, et al. Hydroxocobalamin and sodium thiosulfate versus sodium nitrite and sodium thiosulfate in the treatment of acute cyanide toxicity in a swine (Sus scrofa) model. Annals of Emergency Medicine. 2010;55: 345–51.
- Bebarta VS, Pitotti RL, Dixon P, et al. Hydroxocobalamin and epinephrine both improve survival in a swine model of cyanide-induced cardiac arrest. Annals of Emergency Medicine. 2012;60(4): 415-22.
- Bebarta VS, Pitotti RL, Boudreau S, et al. Intraosseous versus intravenous infusion of hydroxocobalamin for the treatment of acute severe cyanide toxicity in the swine model. Academic Emergency Medicine. 2014;21:1203-1211.
- Brouard A, Blaisot B, Bismuth. Hydroxocobalamin in cyanide poisoning. Journal de Toxicologie Clinique et Experimentale. 1987;7(3): 155-68.
- Hall AH, Rumack BH. Hydroxycobalamin/sodium thiosulfate as a cyanide antidote. Journal of Emergency Medicine. 1987;5(2): 115-21
- Bebarta VS, Tanen DA, Boudreau S, et al. Intravenous cobinamide versus hydroxocobalamin for acute treatment of severe cyanide poisoning in a swine (Sus scrofa) model. Annals of emergency medicine. 2014;64(6): 612-19.
- Dulaney Jr MD, Brumley M, Willis JT, Hume AS. Protection against cyanide toxicity by oral alpha ketoglutaric acid. Veterinary and Human Toxicology. 1991;33:571-5.
- Niknahad H1, Ghelichkhani E. Antagonism of cyanide poisoning by dihydroxyacetone. Toxicol Lett. 2002 Jun 14;132(2):95-100.
- Hoffman RS, Howland MA, Lewin NA, et al. Toxicologic Emergencies. 10th Ed. New York, NY: McGraw-Hill Education; 2015.
- Food and Drug Administration. Pyrodistigmine bromide package insert.
- McDonough JH. Midazolam: An improved anticonvulsant treatment for nerve agent-induced seizures. Paper presented at: ADA409494 Proceedings of the 2001 Edgewood Chemical Biological Center Scientific Conference on Chemical and Biological Defense Research; Mar 2001; Hunt Valley, MD.
- Sidell FR. Nerve Agents. In Medical Aspects of Chemical and Biological Warfare, Textbook of Military Medicine, Part I Warfare, Weaponry and the Casualty (Sidell FR, Takafuji ET, and Franz DR eds). The Office of the Surgeon General. Washington DC. 1997: 129-179.
- Sidell FR. Soman and Sarin: clinical manifestations and treatment of accidental poisoning by organophosphates. Clinical Toxicology. 1974;7(1): 1-17.
- Shih T, McDonough JH. Organophosphorus nerve agents-induced seizures and efficacy of atropine sulfate as anticonvulsant treatment. Pharmacology, biochemistry and behavior. 1999;64:147-153.
- Taylor P. Anticholinesterase agents (Chapter 10) in The pharmacological basis of therapeutics (6th Ed), Gilman AG, Goodman LS, Rall TW, Murad F. Macmillan, New York.1985: 110-129.
- Ward JR. Case report: exposure to nerve gas. In: Whittenberger JL, ed. Artificial respiration: theory and application. New York, NY: Harper and Row; 1962: 258-65
- Harris LW, Gennings C, Carter WH, et al. Efficacy comparison of scopolamine (SCP) and diazepam (DZ) against soman-induced lethality in guinea pigs. Drug and Chemical Toxicology. 1994;17(1): 35-50.
- Koplovitz I, Schulz S. Perspectives on the use of scopolamine as an adjunct treatment to enhance survival following organophosphorus nerve agent poisoning. Military Medicine. 2010;175(11): 878-82.
- Clement JG. Survivors of soman poisoning: recovery of the soman LD50 to control value in the presence of extensive acetylcholinesterase inhibition. Archives of Toxicology. 1989;63(2): 150-54.
- Dawson, R. M. Review of oximes available for treatment of nerve agent poisoning. J. Appl. Toxicol. 1994;14: 317–331. doi:10.1002/jat.2550140502
- Gunnarson M WS, Seidal T, Lennquist S. Effects of inhalation of corticosteroids immediately after experimental chlorine injury. Journal of Trauma and Acute Care Surgery. 2000;48(1): 101.
- Kassa J. Review of Oximes in the Antidotal Treatment of Poisoning by Organophosphorus Nerve Agents. Journal of Toxicology. 2002;40(6): 803-16.
- Snider TH, Yeung DT, Jett, DA, Babin M. Toxicity and median effective doses of oxime therapies against percutaneous organophosphorus pesticide and nerve agent challenges in the Hartley guinea pig. J Toxicol Sci, Jul 2016. ;41(4):511-21.
- Wilhelm CM, Snider TH, Babin MC, et al. A comprehensive evaluation of the efficacy of leading oxime therapies in guinea pigs exposed to organophosphorus chemical warfare agents or pesticides. Toxicology and Applied Pharmacy. 2014;281(3):254-65.
- Worek F, Aurbek N, Thiermann H. Reactivation of organophosphate-inhibited human AchE by combinations of obidoxime and HI 6 in vitro. Journal of Apllied Toxicology. 2007;27(6):582-588.
- Hamilton MG, Lundy PM. HI-6 therapy of soman and tabun poisoning in primates and rodents. Archives of Toxicology. 1989;63(2): 144-49.
- Marrs TC, Maynard RL, Sidell FR. The use of benzodiazepines in organophosphorus nerve agent intoxication. In: Chichester, UK: John Wiley & Sons, Ltd; 2007:331-342
- Shih TM, Duniho SM, and McDonough JH. Control of Nerve Agent-Induced Seizures is Critical for Neuroprotection and Survival. U.S. Army Medical Research Institute of Chemical Defense Report. Jan 2002.
- Diller WF. Early diagnosis of phosgene overexposure. Toxicology and Industrial Health. 1985;1(2): 73-80.
- Nelson LS, Odujebe OA. Simple Asphyxiants and Pulmonary Irritants. In Goldfrank’s Toxicologic Emergencies 10th ed. McGraw Hill. 2015.
- Wang J, Zhang L, Walther SM. Administration of aerosolized terbutaline and budesonide reduces chlorine gas-induced acute lung injury. J Trauma. Apr 2004;56(4):850-862.
- Bosse GM. Nebulized sodium bicarbonate in the treatment of chlorine gas inhalation. Journal of Toxicology – Clinical Toxicology. 1994;32:233-241.
- Vinsel PJ. Treatment of acute chlorine gas inhalation with nebulized sodium bicarbonate. J Emerg Med. 1990 May-Jun 1990;8(3):327-329.
- Guo YL, Kennedy TP, Michael R, et al. Mechanism of phosgene induced lung injury: role of arachidonate mediators. Journal of Applied Physiology. 1990;69(5): 1615-22
- Frosolono MF, Scarpelli EM, Holzman BH, et al. Effect of aminophylline, hydrocortisone, and prostaglandin E1 on survival time and percent lung water in rabbits after exposure to phosgene. American Review of Respiratory Disease. 1978;117(suppl): 233-34.
- Sciuto AM, Strickland PT, Kennedy TP, Gurtner GH. Postexposure treatment with aminophylline protects against phosgene induced acute lung injury. Experimental Lung Research. 1997;23(4): 317 32.
- Kennedy TP, Michael JR, Hoidal JR, et al. Dibutyryl cAMP, aminophylline, and beta-adrenergic agonists protect against pulmonary edema caused by phosgene. Journal of Applied Physiology. 1989;67(6): 2542-52.
- Sciuto AM, Stotts RR, Hurt HH. Efficacy of ibuprofen and pentoxifylline in the treatment of phosgene-induced acute lung injury. Journal of Applied Toxicology. 1996;16(5): 381-84.
- Sciuto AM, Strickland PT, Kennedy TP, Gurtner GH. Protective effects of N-acetylcysteine treatment after phosgene exposure in rabbits. American Journal of Respiratory and Critical Care Medicine. 1995;151(3 Pt 1): 68-72
- Fitzgerald GJ. Chemical warfare and medical response during World War I. American Journal of Public Health. 2008;98(4): 611-25
- Le HQ, Knudsen SJ. Exposure to a First World War blistering agent, Emergency Medicine Journal. 2006;23: 296–99.
- Medical management guidelines for blister agents: sulfur mustard agent H/HD, sulfur mustard agent HT. US Centers for Disease Control and Prevention, Agency for Toxic Substances and Disease Registry Web site.
- Medical management guidelines for blister agents: HN-1HN-2HN-3 nitrogen mustards. US Centers for Disease Control and Prevention, Agency for Toxic Substances and Disease Registry Web site.
- Johns Hopkins Center for Health Security, Sulfur mustard (blister agent) Fact Sheet, 25 Mar 2013.
- Wigenstam E, Jonasson S, Koch B, Bucht A. Corticosteroids treatment inhibits airway hyperresponsiveness and lung injury in a murine model of chemical-induced airway inflammation. Toxicology. 2012;301(103):66-71.
- Vojvodić V, Milosavljević Z, Bosković B, Bojanić N. The protective effect of different drugs in rats poisoned by sulfur and nitrogen mustards. Fundamental and Applied Toxicology. 1985;5(6 Pt 2): S160-8.
- Anderson DR, Byers SL, Vesely KR. Treatment of sulfur mustard (HD)-induced lung injury. Journal of Applied Toxicology. 2000;20(supp 1): S129-32.
- Anderson DR, Holmes WW, Lee RB, et al. Sulfur mustard-induced neutropenia: treatment with granulocyte colony-stimulating factor. Military Medicine. 2006;171: 448-53.
- Vijayaraghavan R, Kumar P, Joshi U, et al. Prophylactic wfficacy of amifostine and its analogues against sulfur musturd toxicity. Toxicology. 2001;163(2-3):83-91.
- Bhattacharya IR, Rao PVL, Pant SC, et al. Effects of Amifostine and Its Analogues on Sulfur Mustard Toxicity in Vitro and in Vivo. Toxicology and Applied Pharmacology. 2001;176(1): 24-33.
- Vilensky JA, Redman K. British anti-Lewisite (dimercaprol): an amazing history. Annals of Emergency Medicine. 2003;41(3): 378-83.
- Medical management guidelines for blister agents: lewisite (L), mustard-lewisite mixture (HL). US Centers for Disease Control and Prevention, Agency for Toxic Substances and Disease Registry Web site.
- Ketchum JS, Sidell, FR. Incapacitating Agents. In: Borden Institute. Textbook of Military Medicine: Medical Aspects of Chemical Warfare. United States Department of Defense. 2009.
- Burns MJ, Linden CH, Graduins A, et al. A comparison of physostigmine and benzodiazepines for the treatment of anticholinergic poisoning. Annals of Emergency Medicine. 2000;35(4):374-381.
- Wetherall J, Hall T, Passingham S. Physostigmine and hyoscine improves protection against the lethal and incapacitating effects of nerve agent poisoning in the guinea pig. Neurotoxicology. 2002;23:341-349.
- Boyer E. Management of opioid analgesic overdose. The New England Journal of Medicine. 2012;367(2): 146-55.
- Schep LJ, Slaughter RJ, McBride DI. Riot control agents: the tear gases CN, CS and OC-a medical review. Journal of the Royal Army Medical Corps. 2015;161(2): 94-9.
부록
부록 A: 아트로핀/스코폴라민 투여 절차
한 명의 부상자 처치에 대한 요구 품목량
- 스코폴라민 0.4㎎/㎖ 바이알 × 2
- 아트로핀 8㎎/20㎖ 바이알 × 3
- 3㎖ 주사기 × 1
- 소형 점적 투여 조절기 × 1
- 18G 바늘 × 1
- 압력 주입기 ×1
- 250㎖ NS 백 × 1
- FAST1™ (IO 장비) 및 세척(Flush) 또는 IV 수액 세트 × 1
준비 사항
신경작용제/유기인산염/카바메이트 노출 환자 관리
- 스코폴라민 준비:
- 스코폴라민 0.4㎎/㎖ 바이알에서 0.8㎎ (2㎖)를 3㎖ 주사기로 뽑는다.
- 주사기에 18G 바늘을 끼우고 캡으로 덮는다.
- 주사기에 'SCOPE 0.8㎎/2㎖' 라고 쓰인 라벨을 붙인다.
- 아트로핀 점적용 용액 준비:
- 8㎎/20㎖ 아트로핀 50㎖를 250㎖ NS 백에 주입한다.
- 혼합된 NS의 최종 농도는 20mg/300mL이다. 공기를 제거하고, 백에 잔여 공간이 거의 없는 것을 확인한다.
- NS 백에 'ATROPINE 20㎎/300㎖ approx. 1mg/3min'라고 쓰인 라벨을 붙인다.
투여 절차
ATNAA 3회와 CANA 1회를 IM 투여한다. 환자 상태가 개선되지 않을 경우, 스코폴라민(선호됨) 또는 아래의 프로토콜에 따라 아트로핀을 투여할 것.
- ATNAA 3회와 CANA 1회 투여에 대한 반응이 불충분한 경우, 스코폴라민 하이드로브로마이드 0.8㎎을 IV / IO 투여한다. IM 투여는 보조 역할임.
또는
- 3-5분마다 아트로핀 1 볼루스만큼 증량 투여한다. 2㎎부터 시작하여 4㎎, 8㎎, 16㎎까지 투여한다.
- 증상이 안정되면 위에서 설명한 바와 같이, 준비된 아트로핀을 시간당 볼루스 용량의 10% (초기 ATNAA 3회 투여 시 아트로핀 6㎎을 포함)로 점적 투여한다.
- 증상이 재발하면 재투여를 실시하고, 점적 주입 속도를 초기 용량의 20%/시간으로 증량 투여한다.
- 스코폴라민 0.8㎎의 초기 반응 용량을 계산할 때는, 아트로핀 10㎎에 상응하는 용량으로 계산한다.
- 점적 주입 속도를 시간당 300㎖로 설정하면, 아트로핀은 약 3분당 1㎎으로 투여된다.
참고: 본 절차는 이러한 약물을 일상적으로 사용하지 않는 처치 제공자를 위한 출발점으로 사용하기 위함임. 본 절차에 대해서는 비의료면허자를 감독하는 의사에 의해 검토되어야 한다. 본 절차는 제공 책임자의 임상 판단을 대체 하지 않는다.
- 신경작용제 노출시 행동 순서는 다음과 같다
- ATNAA × 3
- CANA × 1
- IO 접근
- TXA 2g (외상을 수반하는 경우)
- 500㎎ 2-PAM IV / IO Push 투여 (15-20분 반응 기대)
- 스코폴라민 0.8㎎ IV / IO
- 아트로핀 2㎎ IV / IO 투여 후 3-5분마다 두 배로 증량 투여
- (아트로핀 투여로 분비물이 줄었음에도 의식 상태에 변화가 없는 경우) 숨겨진 발작(Clinical Seizures) 반응 시 미다졸람 10㎎ IV / IO 투여
- 2-PAM IV 점적 투여
부록 F: CPG상 오프라벨 사용에 대한 정보
목적
이 부록의 목적은 FDA 승인 제품의 오프라벨 사용을 CPG에 포함하는 것과 관련된 국방부(DoD) 정책과 관행에 대한 이해를 보장하는 것이다. 이는 군 환자를 대상으로 한 오프라벨 사용에 적용된다.
배경
FDA 승인 제품의 비승인(즉, 오프라벨) 사용은 미국 의료에서 매우 일반적이며, 보통 특별한 규제를 받지 않는다. 그러나 연방법에 따라 일부 상황에서는 승인된 약물의 비승인 사용이 "임상시험용 신약(IND)" 규정을 적용받을 수 있다. 이러한 상황에는 임상시험의 일부로 사용되는 경우와 군대 맥락에서 지휘부가 요구한 비승인 사용이 포함된다. 또한, 일부 지휘부 요청에 의한 비승인 사용은 특별 규제의 대상이 될 수도 있다.
CPG상 오프라벨 사용에 대한 추가 정보
CPG에 오프라벨 사용을 포함하는 것은 임상시험도, 지휘부 요청이나 의무도 아니다. 또한 이는 군 의료 체계가 국방부 의료 제공자에게 해당 사용을 요구하거나 이를 "표준 진료"로 간주함을 의미하지 않는다. 오히려, CPG에 오프라벨 사용을 포함하는 목적은 책임 있는 의료 제공자가 치료 대안의 잠재적 위험과 이점을 파악하여 임상적 판단을 내릴 수 있도록 정보를 제공하는 데 있다. 이러한 결정은 의료 제공자와 환자 간 관계에서 이루어지는 임상적 판단에 달려 있다.
추가적인 절차
균형 잡힌 논의
이러한 목적에 부합하도록, CPG에서 오프라벨 사용을 다루는 경우에는 해당 사용이 FDA에서 승인하지 않은 용도임을 명시적으로 밝혀둔다. 또한, 그러한 설명에는 임상 연구 데이터 중 해당 제품 사용에 주의가 필요함을 시사하는 내용이나, FDA에서 발행한 경고 사항 등을 포함한 정보가 균형 있게 제시된다.
품질 보증 모니터링
오프라벨 사용과 관련하여, 미 국방부(DoD)는 결과와 알려진 잠재적 이상 반응에 대한 정기적인 품질 보증 모니터링 체계를 유지한다. 이 때문에 정확한 임상 기록의 중요성이 더욱 강조된다.
환자에게 정보 전달
적절한 환자 정보 제공은 우수 임상 실무(good clinical practice)의 일부다. 오프라벨 사용 중에서도 이례적인 용도를 다루는 CPG 각각에서, 환자에게 제공해야 할 정보의 중요성을 명시한다. 가능한 경우, 제품 사용 전이나 후에 환자에게 배포할 수 있는 적절한 정보지를 부록에 포함하는 방안을 고려한다. 이 부록에는 해당 용도가 FDA로부터 승인받지 않은 사용이라는 점, 미 국방부(DoD) 의료인이 이러한 용도로 제품 사용을 결정하는 이유, 이러한 사용과 관련된 잠재적 위험 요소 등이 포함된다. 해당 환자에 대한 정보에는 이러한 내용이 알기 쉬운 언어로 안내되어야 한다.
'학술 및 일반 자료 번역 > TCCC' 카테고리의 다른 글
| [번역] 병원 전 단계에서 승압제 투여가 전투 부상자의 사망률 증가와 관련이 있음에 관하여 (4) | 2024.12.13 |
|---|---|
| [번역] 트롬빈과 트라넥삼산이 포함된 자가 추진 드레싱으로 치명적인 접합부 출혈 돼지 모델에서 단기 생존율이 향상 (1) | 2024.11.30 |
| [번역] 응급 의료 서비스에서의 기흉 (1) | 2024.06.18 |
| [번역] JTS-CPG CBRN Injury Response Part Ⅰ: Initial Response to CBRN Agents (0) | 2024.05.26 |
| [번역] 전술적전투부상자처치 2024년도 가이드라인: 교전 중 처치(CUF) (0) | 2024.05.26 |
