트롬빈과 트라넥삼산이 함유된 자가 추진 드레싱으로 치명적인 접합부 출혈의 돼지 모델에서 단기 생존율이 향상
Self-propelled dressings containing thrombin and tranexamic acid
improve short-term survival in a swine model of lethal junctional hemorrhage
요약
출혈은 외상에서 예방 가능한 사망의 주요 원인으로, 특히 압박이 불가능한 접합부 해부학적 부위에서 발생하는 출혈은 통제가 매우 어렵다. 현재 표준 처치 방법은 3분간의 압박이 필요한 QuikClot Combat Gauze 삽입이다. 우리는 흐르는 혈액을 거슬러 상류로 스스로 확산 및 추진할 수 있는 탄산칼슘 미세입자를 포함한 새로운 드레싱을 개발하였다. 이 미세입자에 트롬빈과 트라넥삼산을 주입하여 상처 압박 없이 돼지 동맥 출혈 모델에서 그 효능을 평가하였다.
마취된 어린 암컷 돼지의 대퇴동맥을 5mm 절개하여 심각한 접합부 출혈을 유도하였다. 상처는 카올린 기반 QuikClot Combat Gauze(KG), 추진형 트롬빈-미세입자와 양성 트라넥삼산(PTG), 또는 비추진형 트롬빈-미세입자와 음성 트라넥삼산(NPTG)등으로 처치하였으며 드레싱 후에는 상처를 압박하지 않았다. 각 동물에게 15㎖/㎏ 의 하이드록시에틸 전분 용액(HES)을 1회 투여한 뒤, 저혈압 발생 시 필요에 따라 최대 100㎖/㎏ 까지 유산화 링거액을 주입하며 3시간 동안 관찰하였다.
PTG 사용군은 KG(3/8, 37.5%) 및 NPTG(2/8, 25%)와 비교하여 생존율이 유의미하게 향상되었다(3시간 생존율: 8/8, 100%, ${p}$<0.01). PTG 사용군은 NPTG와 비교했을 때 혈청 젖산 농도가 더 낮고 혈중 헤모글로빈 농도가 더 높았으며(${p}$<0.05), 이는 PTG가 후속 출혈성 쇼크의 중증도를 감소시켰음을 시사한다. 그러나 총 혈액 손실량, 유산화 링거액 투여량, 생존 동물의 평균 동맥압은 그룹 간 유의미한 차이가 없었다(${p}$>0.05).
따라서, 접합부 동맥 출혈 돼지 모델에서 친혈전성 미세입자를 포함한 자가 추진 거즈는 압박 없이도 생존율과 출혈성 쇼크의 두 가지 지표를 개선하였으며, 이는 압박이 어려운 접합부 상처의 치료를 향상시킬 가능성을 시사한다.
키워드: 탄산칼슘, 기포 추진, 출혈 통제, 카올린, 출혈 쇼크
서론
외상은 미국과 전 세계에서 주요한 이환율과 사망률의 원인으로 남아 있다.¹·² 출혈은 군에서 외상 관련 사망의 주요 원인이며, 민간 부문에서는 두 번째로 큰 원인으로, 예방 가능한 외상 사망의 주요 요인이다.³⁻⁶ 외상 환자의 예후를 개선하려면 출혈을 조기에 통제하는 것이 필수적이다.³·⁵·⁷
전투 상황에서 치명적인 출혈이 발생하는 두 번째로 흔한 부위는 사타구니, 목, 겨드랑이와 같은 접합부 해부학적 부위이다.³ 접합부 출혈은 팔다리 지혈대를 이 부위의 근위부에 적용할 수 없기 때문에 전단계 응급 치료에서 특히 통제하기 어렵다.⁸ 보고서에 따르면, 아프가니스탄에서 캐나다군 전투 사상자의 약 5%는 접합부 출혈을 효과적으로 통제했다면 생명을 구할 수 있었을 것으로 추정된다.⁹
접합부 상처의 현장 관리는 상처 압박, 거즈 삽입 및/또는 출혈 부위 근위부에 적용되는 외부 압박 장치를 통한 간접 혈관 압박을 포함한다(여기에는 여러 유형의 접합부 지혈대가 포함된다).¹⁰ 지혈 거즈 제조업체들은 삽입 후 최소 3분간의 직접적인 상처 압박을 권장하지만, 외부 압박 장치의 사용은 종종 크기가 크고 훈련이 필요하며, 말초 혈류를 완전히 차단할 가능성이 있기 때문에 전단계 응급 상황 및 전투 환경에서는 의문이 제기된다.⁸·¹¹⁻¹⁴ 이러한 제한 사항으로 인해 전투 상황 중 응급 치료 단계에서는 신속한 출혈 통제를 위한 적합한 선택지가 거의 없다. 따라서, 압박 없이도 효과적으로 작동할 수 있는 적절한 거즈 드레싱이 필요하다. 혈액이 외부로 흐르는 상황에서도 효과를 유지할 수 있는 거즈 드레싱은 전투 상황과 같이 시간이 중요한 응급 상황뿐만 아니라 압박이 불가능한 해부학적 부위에서도 이상적인 해결책이 될 것이다.
자가 추진 입자는 최근 약물 전달과 지혈을 위해 개발되었다. 응고 촉진제가 주입된 입자는 출혈 부위에 적용되어 혈류를 거슬러 상류로 입자를 전달하고, 상처 내에서 자가 분산하여 손상 부위에서 지혈을 촉진할 수 있다. 이러한 기능은 동맥 출혈이 활발히 진행 중인 상처에서도 가능하다(그림 1A). 이전 연구에서는 물이나 혈액에 놓였을 때 발포하고 자가 추진하는 입자 시스템을 개발하였다.¹⁵ 이 입자는 트롬빈이 흡착된 탄산칼슘(CaCO₃)으로 구성되며, 고체 형태의 양성 트라넥삼산과 물리적으로 혼합되어 있다. 이 입자가 혈액과 같은 수용액에 놓이면 이산화탄소 가스를 방출하며(그림 1B), 기포는 입자와 화물에 힘을 가하여 응고 촉진 효소인 트롬빈을 출혈 부위 깊숙이 운반하고 혈전 형성을 유도한다.
이 입자는 저량 출혈을 모사한 미세유체 모델 하나와 마우스 모델 두 개에서 혈류를 거슬러 추진할 수 있었다. 음성 트라넥삼산과 혼합된 경우, 입자는 발포하거나 추진하지 않지만, 트롬빈과 트라넥삼산은 여전히 치료 효과를 유지하였다. 이전 연구에서 이러한 입자는 마우스 꼬리 절단 및 간 손상 모델에서 출혈을 줄이는 효과적인 지혈제로 확인되었다. 그러나 인간의 전투 손상에서 나타나는 출혈량과 압력을 모사하려면 전투와 관련된 대동물 모델이 필요하다.¹⁵
이전에 발표된 연구에는 시범 연구가 포함되어 있었으며, 자가 추형 트롬빈이 주입된 입자를 거즈에 적용하여 소규모 돼지 집단에서 대퇴동맥 손상 및 출혈 후의 생존율을 증가시켰다. 본 연구에서는 이 연구를 확장하여 더 큰 집단을 대상으로 추가 임상 매개변수를 측정하고, 현재 전술적 전투 부상 처치 위원회(Committee on Tactical Combat Casualty Care)에서 전장에서의 사용을 위해 승인한 카올린을 기반으로 하는 QuikClot Combat Gauze® (KG), 붕대(Z-Medica, Wallingford, CT)와 비교 실험을 수행하였다. 우리는 이러한 탄산 입자의 추진 작용을 통해, 치명적 접합부 출혈 돼지 모델에서 KG에 비해 3시간 생존율이 향상될 것이라고 가정하였다.
재료 및 방법
거즈 준비
CaCO₃ 및 트롬빈이 적재된 거즈를 준비하기 위해, CaCO₃ 미립자(American Elements, Los Angeles, CA) 8g을 60 ㎍/㎖ 인체 트롬빈(특이 활성 약 4000 U/㎎, Haematologic Technologies, Essex Junction, VT)을 포함하는 글리신 완충 식염수(GBS, 40mM glycine, 171mM NaCl, pH 7.2) 8㎖에 현탁하고 얼음 위에서 20분 동안 반응시켰다. 현탁액은 추가로 GBS 8 ㎖로 희석하여 약 3g의 Kerlix™ 거즈(Covidien, Dublin, Ireland) 조각에 부은 뒤 동결 건조하였다. Kerlix는 비지혈성 거즈 치료의 표준으로 선택되었으며, Combat Gauze는 현재 미군이 사용하는 지혈 거즈의 표준으로, 제조사가 카올린을 첨가하여 생산한 제품이다.
양성자화된 TXA가 적재된 거즈를 준비하기 위해, pH 4.3의 트라넥삼산(TXA, Chem-Impex International, Wood Dale, IL) 수용액(300g/ℓ)을 동일량의 Kerlix 거즈에 적용한 후 혼합물을 동결 건조하였다. 중성 TXA가 함유된 거즈를 준비하기 위해서 pH 7.3의 TXA 수용액을 사용하였다. CaCO₃ 및 트롬빈이 함유된 거즈는 양성자화된 TXA 거즈와 층을 이루도록 배치하여 추진 트롬빈+TXA 거즈(PTG)를 생성하거나, 중성 TXA 거즈와 층을 이루도록 배치하여 비추진 트롬빈+TXA 거즈(NPTG)를 생성하였다. 거즈는 개별 밀봉된 용기에 보관되었으며, 적용 직전에 표준 길이와 너비로 절단하여 출혈 상처를 채우기에 적합하도록 거즈 템플릿을 사용해 다듬었다.
이들 거즈가 적용된 이후의 투여량은 다음과 같이 계산되었다: CaCO₃ 267㎎/㎏, TXA 157㎎/㎏, 사람 트롬빈 1.67×10⁻² ㎎/㎏ (67 IU/㎏). CaCO₃ 및 TXA의 용량은 거즈에 적재할 수 있는 최대량이었으며, 트롬빈의 용량은 상업적으로 이용 가능한 트롬빈 제품의 치료 용량과 유사하였다.
동물의 준비 및 계장
이 프로토콜 (그림 2)은 국소 지혈제를 평가하기 위해 미 육군에서 광범위하게 사용되고 출판된 기존 방법을 수정한 것이다.¹⁶⁻¹⁸ 이전 연구에서 이 모델은 처치 없이는 100% 치명적인 것으로 나타났으며, 핵심 생존 시간은 36분이었다.¹⁹ 모든 동물 처리 및 절차는 워싱턴 대학교 동물 복지 사무국 또는 브리티시컬럼비아 대학교 동물 관리 위원회의 승인을 받았으며, 캐나다 동물 관리 위원회 및 국립보건원(NIH)의 실험동물 사용 지침에 따라 수행되었다.
25~30㎏ 요크셔 교배형 미성숙 암컷 돼지는 연구 전날 밤 물은 자유롭게 섭취하도록 하면서 금식 상태로 두었다. 연구 당일 아침, 돼지는 케타민(30 ㎎/㎏ IM)으로 진정시키고, 이소플루레인(2~3%)과 산소(33%) 혼합제를 코 마스크를 통해 흡입하여 마취를 유도했다. 동물은 구강 기관 삽관을 실시했으며, 진통제로 부프레노르핀(0.01 ㎎/㎏ IM)을 1회 투여했다. 이후 이소플루레인 농도는 1~1.5%로 유지했다.
동물의 정상적인 pH, pCO₂ 및 혈중 산소 포화도를 유지하기 위해 기계적으로 환기(Anesco Anesthesia Ventilator)되었으며, EtCO₂ 농도는 지속적으로 모니터링(Datex Capnomac Ultima, Datex Instrumentarium Corp)하였으며, 양측 대퇴부는 면도 후 포비돈-아이오딘 용액으로 소독하였다. 좌측 대퇴 동맥과 정맥은 분리 후 중심 혈압 모니터링, 혈액 샘플 채취, 그리고 약물 및 수액 투여를 위해 카테터를 삽입하였다. 좌측 대퇴 동맥 카테터는 하복부 대동맥까지 삽입되었다. Biopac MP150 모니터링 및 데이터 수집 시스템(Biopac System, Inc., Santa Barbara, CA)을 이용하여 생체 신호와 혈역학 변수를 지속적으로 기록하였다.
우측 대퇴부에는 서혜부 주름에서 원위부로 연장되는 4㎝ 길이의 종적 절개를 실시하여 대퇴 동맥을 노출시켰다. 대퇴 동맥은 주변 조직으로부터 무딘 박리(blunt dissection)로 분리되었으며, 모든 소동맥 가지는 결찰하고 노출된 동맥은 2% 리도카인 용액 5㎖로 처리하여 동맥을 확장시키고 손상 후 혈관 연축 작용을 방지하였다.
부상 프로토콜
30분간의 평형 시간이 지난 후 기초 측정값을 기록하였다. 격리된 우측 대퇴 동맥에 근위부 및 원위부 동맥 클립을 설치한 뒤, 원형 펀치 생검 도구를 사용하여 혈관 전벽에 직경 5㎜로 동맥 절개(arteriotomy)를 생성, 동맥이 절단되지 않도록 주의하였다. 혈관 클립을 제거하기 전에는 혈액이 고여 자발적인 혈전 형성이 일어나지 않도록 상처 부위를 깨끗하게 유지하였다.
혈관 클립을 제거하여 출혈을 유도했으며, 동맥에서 30초간 자유롭게 출혈이 진행되도록 두었다. 자유 출혈이 끝난 후, 단일 작업자가 상처를 표준화된 양의 PTG, NPTG 또는 KG(말려 있는 형태)로 손가락으로 채워 상처를 완전히 메웠다. PTG와 NPTG 거즈는 동결 건조된 상태로 인해 KG보다 약간 더 뻣뻣했지만, 상처를 완전히 채우는 데는 차이가 없었다. 거즈가 삽입된 상태에서 피부는 열려 있게 두었으며, 수동 압박은 적용하지 않았다.
수액 소생
출혈이 시작된 지 3분 30초 후, 모든 동물에게 Hextend™(6% 헤타스타치 평형염액, Hospira, Lake Forest Park, IL) 15㎖/㎏을 15분에 걸쳐 정맥으로 투여하고, 이어 평균 동맥압(MAP)을 60㎜Hg로 유지하기 위해 필요한 경우 최대 100㎖/㎏ 까지 3㎖/㎏/분의 속도로 링거액을 주입하였다.
동물은 출혈 후 3시간 동안 또는 사망 시점까지 관찰되었다. 사망 원인은 동맥 파형에서 맥압의 소실로 정의되었다. 사망 시 또는 3시간 생존 시점에 도달한 동물은 마취 상태에서 펜토바르비탈 과다 투여(100 ㎎/㎏)로 안락사시켰다.
결과 측정
생존 시간은 최대 3시간까지 측정; 출혈량은 사전에 무게를 측정한 스펀지를 사용하여 모든 출혈 혈액을 수집함으로써 측정되었습니다. 프로토콜 상 한 번의 거즈 적용만 허용되었기 때문에, 재출혈이 발생해도 추가 개입이 허용되지 않아 다른 보고된 프로토콜과 달리 지혈에 걸리는 시간(time to hemostasis)은 기록되지 않았다. 평균 동맥압(MAP)은 하복부 대동맥의 동맥 카테터를 통해 기록되었으며, 동맥 혈액의 젖산 농도와 응고 지표도 연속적으로 측정되어 그룹 간 비교되었다. 혈액 샘플은 기초값(baseline)과 손상 후 3, 15, 30, 60, 90, 120, 150, 180분 또는 사망 시점에 채취되었다.
START-4 응고 분석기(Diagnostica Stago, Asnières, France)를 사용해 원심 분리한 혈소판-결핍 혈장에서 Clauss의 수정된 방법으로 피브리노겐 농도를 측정하였다. 응고 형성 지표는 구연산 처리된 혈액의 단순 재칼슘화(thrombelastography, TEG, Haemonetics, Braintree, MA)를 통해 평가하였다.
PTG 돼지 하위 집단의 혈장 내 TXA 농도는 관찰 기간 동안, NPTG 돼지 하위 집단에서는 0분과 120분 시점에서 측정되었다. 혈장 내 TXA 농도는 고체상 추출법으로 샘플을 정제한 후, 친수성 상호작용 액체 크로마토그래피와 다중 반응 모니터링 검출을 활용한 초고성능 액체 크로마토그래피–질량 분석법으로 분석하였다.
PTG 및 NPTG 동물의 혈장 내 TXA 농도(${TXA_{plasma}}$)를 사용하여 전신 트롬빈 용량(${D_{systemic \, thrombin}}$)을 다음 방정식을 통해 추정하였다:
$$ D_{systemic \, thrombin} = \frac{\left [ TXA \right ]_{plasma} \times V_{blood}}{m_{gauze \, TXA}} \times \frac{a_{gauze \, thrombin}}{m_{pig}}$$
여기서 ${V_{blood}}$는 동물의 혈액 총량(65㎖/㎏로 가정), ${m_{gauze \, TXA}}$는 거즈 내 트라넥삼산의 질량, ${a_{gauze \, thrombin}}$은 거즈 내 트롬빈의 활성도, ${m_{pig}}$는 동물의 체중을 의미하며, 이 방정식은 흡수된 트롬빈 총량의 비율이 트라넥삼산의 흡수율과 동일하다고 가정하므로, 전신 트롬빈 용량을 과대 추정할 가능성이 있다.
통계 분석
이전 연구 보고를 바탕으로, 그룹 간 3시간 생존율에서 반수의 차이를 감지하기 위해 각 그룹당 8마리의 동물이 필요하다고 계산되었다.¹⁶ 평균 동맥압(MAP), 출혈량 및 평균 출혈률, 유산화 링거액 주입량 및 평균 주입률, 혈청 젖산 농도, 혈중 헤모글로빈 농도, 혈소판 수치, 피브리노겐 농도, 그리고 트롬보엘라스토그램 최대 진폭(TEG MA)을 측정하여 생존율 차이를 설명하고, 향후 더 많은 동물을 포함한 연구의 방향을 설정했다. 그러나 본 연구는 이러한 매개변수에서 유의미한 차이를 감지하도록 설계되지는 않았다.
모든 통계 분석은 JMP(SAS Software, Cary, NC)를 사용하여 수행하였다. 생존 시간은 Kaplan-Meier 생존 분석과 로그-순위 검정(log-rank test)을 통해 비교하였으며 생존 시간당 누적 출혈량과 생존 시간당 유체 요구량은 일원 분산 분석(one-way ANOVA)을 통해 비교하였다. MAP 및 실험실 수치는 반복 측정 분산 분석(RM-ANOVA)을 사용하여 시간에 따른 변화( ${p_{Protocol \, Time}}$), 치료 그룹 간 차이( ${p_{Treatment}}$ ), 및 거즈 치료가 시간에 따라 이러한 매개변수에 미친 영향을 평가( ${p_{Interaction}}$ )하였다. 한 혈액 샘플(NPTG 그룹, 기초값)은 응고로 인해 분석할 수 없었으며, 다른 동물들의 기초값 피브리노겐 농도의 평균값으로 보간하였다. ${p_{Treatment}}$<0.05인 변수와 ${p_{Interaction}}$<0.05인 변수의 각 시점에서 사후 쌍별 비교(post hoc pairwise comparison)를 수행했으며, 다중 비교에 대해서는 Tukey 조정을 적용하였다. 모든 분석에서 ${p}$ 값이 0.05 미만인 경우를 통계적으로 유의미한 것으로 간주하였다.
결과
PTG는 NPTG 및 KG 그룹에 비해 생존율이 증가하였다(그림 3A, ${p}$<0.01). 3시간 시점에서 PTG를 받은 돼지의 100%(8/8)가 생존했으나, NPTG와 KG를 받은 돼지는 각각 25%(2/8)와 37.5%(3/8)만 생존하였다. PTG 그룹의 돼지는 NPTG 및 KG 그룹에 비해 평균 출혈량, 평균 출혈 속도, 평균 유산화 링거액 주입 속도가 낮은 경향을 보였으나, 이러한 차이는 통계적으로 유의미하지 않았다(그림 3B–C, 표 1). NPTG 및 KG 그룹의 높은 사망률로 인해 생존 동물의 평균 동맥압(MAP, ${p_{Treatment} = 0.145}$ 및 ${p_{Interaction} = 0.967}$) 또는 유산화 링거액 주입량에서 차이를 감지할 통계적 파워가 충분하지 않았다.
거즈 치료는 혈청 젖산 농도에 유의미한 그룹 효과를 보였다(그림 3D, ${p_{Treatment}}$ < 0.001). PTG를 받은 동물은 NPTG를 받은 동물보다 젖산 농도가 낮았으나(${p}$ = <0.001, KG를 받은 동물과는 유의미한 차이를 보이지 않았다(${p}$ = 0.938). 거즈 치료는 혈중 헤모글로빈 농도에서도 유의미한 그룹 효과를 보였으며(${p_{Treatment}}$ = 0.005, PTG를 받은 동물은 NPTG를 받은 동물보다 헤모글로빈 농도가 높았으나(${p}$ = 0.012), KG를 받은 동물과는 유의미한 차이를 보이지 않았다(${p}$ = 0.921). 시간과 치료 간의 상호작용은 헤모글로빈 농도에 유의미하지 않았다(${p_{Interaction}}$ = 0.724). 혈소판 수, 피브리노겐 농도, TEG MA는 사망 시점 또는 안락사 시점에서 측정되었으며, 이는 표 1과 그림 1에서 확인할 수 있다.
PTG 그룹의 혈장 TXA 농도는 손상 후 2시간에 약 6㎍/㎖(38㎛)로 증가했고, 3시간에 8㎍/㎖(51㎛)로 증가하였다(그림 4). NPTG 그룹은 2시간 및 3시간 시점에서 각각 평균 TXA 농도가 3㎍/㎖(19㎛)와 9㎍/㎖(54㎛)이었다. PTG와 NPTG 간의 혈장 TXA 농도에는 유의미한 차이가 없었다.
모든 그룹에서 대퇴 동맥은 안락사 후 절제되어 검사되었으며, 혈관은 개방되어 있었으며 폐쇄되거나 혈전이 형성되지 않았다.
논의
자가 추진형 트롬빈 및 트라넥삼산(TXA) 입자가 함유된 거즈로 치료한 동물은 압박 없이 진행된 접합부 출혈 모델에서 QuikClot Combat Gauze 또는 비추진 대조군으로 치료한 동물에 비해 유의미하게 높은 생존율을 보였다. 따라서, 자가 추진형 거즈는 해부학적 위치나 시간 제약으로 인해 직접 압박이 어려운 전투 관련 상처에 유용할 수 있다.
PTG로 치료받은 동물은 평균 출혈량이 가장 낮았지만, 차이는 유의미하지 않았지만 NPTG와 비교하여 유의미하게 낮은 젖산 농도와 높은 헤모글로빈 농도를 보였다. 이는 PTG가 생존율을 증가시키는 주된 메커니즘이 출혈 조절임을 시사한다. 헤모글로빈 농도의 차이는 출혈 및 결정질 수액 복구로 인한 혈액 희석(hemodilution)이 대조군의 높은 사망률에 기여했을 가능성을 제시한다.
PTG와 KG 동물 간 젖산 농도와 출혈량을 비교했을 때 비슷한 경향이 관찰되었지만, 차이는 유의미하지 않았다. 유산화 링거액 주입량이 그룹 간 유사했기 때문에, NPTG 그룹의 높은 젖산 농도는 외부에서 주입된 젖산이 아닌 더 심각한 쇼크로 인한 결과일 가능성이 높다. 젖산 제거 능력의 저하는 외상 환자에서 사망률을 예측하는 지표이며, 초기 젖산 농도가 ≥ 4.0㎎/㎗인 환자는 사망 위험이 약 3.8배 증가한다.²⁰⁻²³ 이러한 결과는 NPTG를 받은 동물이 3시간 동안 생존했다 하더라도 관찰 시간이 증가하면 사망 가능성이 더 높아질 수 있음을 시사한다. 따라서, 본 연구에서 PTG가 생존에 기여한 주요 요인은 출혈 감소로 판단된다. 그러나 이를 확증하려면 더 많은 동물을 포함한 추가 연구가 필요하다.
본 연구는 생존율의 차이를 감지하기 위해 설계되었으므로, 이차 결과의 차이를 감지하는 데 제한이 있었다. 특히 NPTG 및 KG 그룹의 높은 사망률로 인해 그룹 내에서도 결과의 변동성이 컸다. 또한, 통계 모델은 3시간 이전에 사망한 동물의 검열(censoring)을 고려하지 않았다. 예를 들어, 프로토콜 초기에 사망한 동물은 출혈이나 링거액 주입이 더 이상 진행되지 않았다.
결과적으로 KG 및 NPTG 그룹에서 동물의 빠른 사망은 시간에 따른 출혈량과 대사 측정을 비교하는 데 한계를 초래하였다. 더 큰 표본 크기 또는 비치명적 출혈 모델을 사용한다면 MAP, 출혈량, 유산화 링거액 요구량과 같은 이차 결과에서 유의미한 차이를 확인할 가능성이 있다. 관찰된 생존 시간당 평균 출혈량과 분산을 기준으로 그룹 간 이질성을 80% 검출력과 α=0.05로 감지하려면 각 그룹당 21마리(총 63마리)의 동물이 필요하며, 이는 본 연구의 범위를 초과한다.
PTG와 NPTG 그룹 모두에서 TXA 및 트롬빈의 흡수는 낮았다. 두 그룹 모두 혈장 내 TXA 농도는 경구 또는 정맥 TXA의 임상적 목표치(1mM)보다 훨씬 저조하였다. 두 그룹 간 TXA 농도의 유사성은 가스 생성 및 추진과 무관하게 상처 조직으로 일반적으로 흡수되었음을 시사한다.²⁴
TXA의 미세몰 농도는 시험관 내에서 섬유소 용해를 억제하며, 상처 내 국소 TXA 농도는 훨씬 높을 가능성이 있어 PTG와 NPTG가 국소 및 전신적으로 섬유소 용해를 억제할 가능성이 있다.²⁵ 그러나 트롬빈 또는 TXA 단독으로 포함된 PTG 또는 NPTG의 효능은 평가되지 않았으므로, 트롬빈과 TXA의 상대적 지혈 기여는 분리되지 않았다. TXA와 트롬빈이 같은 화학양론적 비율로 흡수된다고 가정할 때, PTG 및 NPTG 사용 후 전신 순환으로 들어가는 트롬빈의 최대량은 체중㎏당 0.3 IU로 추정된다. 그러나 트롬빈의 분자량(36,000 Da)이 TXA(157 Da)에 비해 훨씬 크므로 흡수는 동일하지 않을 가능성이 높다. 이 트롬빈 용량은 정맥 투여 가능한 최대 허용 용량(400 IU/㎏)의 0.1%로, 투여 후 수분 내에 항트롬빈에 의해 빠르게 억제다.²⁶·²⁷ 따라서 PTG 또는 NPTG의 트롬빈 함량과 관련된 혈전 형성 위험은 낮을 것으로 보인다. 개별 성분의 독성과 약리학을 엄격히 검증하기 위한 추가 연구가 필요하다.
전체적으로, 이 새로운 드레싱을 사용하는 데에는 여러 가지 이점이 있다. 첫째, 본 연구 결과는 이 드레싱이 압박이 불가능한 상처나 시간에 민감한 시나리오(예: 교전 중 처치)에서 출혈량을 줄일 수 있음을 시사한다. 현재 이러한 상황에서 권장되는 유일한 지혈 개입 방법은 지혈대 처치이므로, 이 드레싱은 부상 후 처음 몇 분 이내에 대량 출혈을 방지하는 데 중요할 수 있다. 둘째, 젖산산증의 정도를 줄이는 것은 조직 관류가 개선되었음을 나타내며, 이는 이후 발생할 수 있는 이환율과 사망률을 최소화할 가능성이 있다. 마지막으로, 이 드레싱은 자가 추진형 미세입자를 활용하여 다양한 친혈전성 또는 상처 치유 물질을 상처 내부에 전달할 수 있는 치료법 개발 가능성을 보여준다.
결론적으로, PTG는 치명적인 접합부 출혈 돼지 모델에서 초기 생존율을 향상시키는 것으로 나타났다. 응고 지표는 혈전 형성이나 독성의 뚜렷한 징후를 보이지 않았으나, 현재의 실험적 조제로부터 인간에게 적합한 제품으로 전환하기 위해 추가적인 안전성 검증이 필요하다. 안전성이 입증된다면, 자가 추 드레싱은 전투, 응급 처치 및 임상 환경에서 출혈 관리를 개선하고 사망률을 줄이기 위한 유망한 대안이 될 수 있을 것이다.
그림 및 표
그림 1

그림 2

그림 3
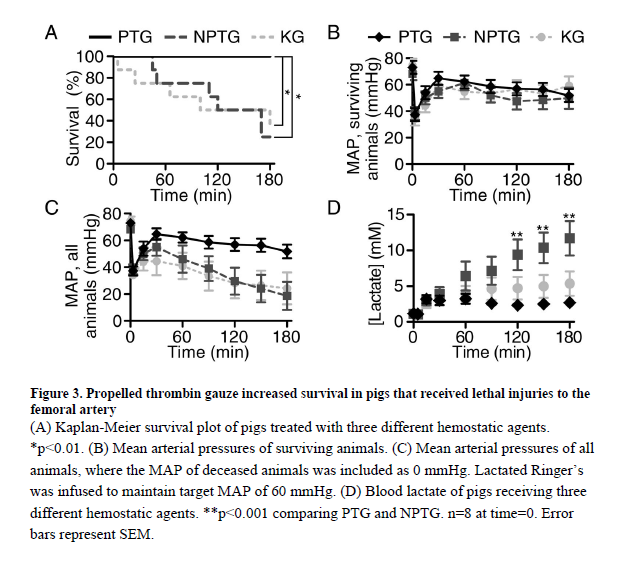
그림 4
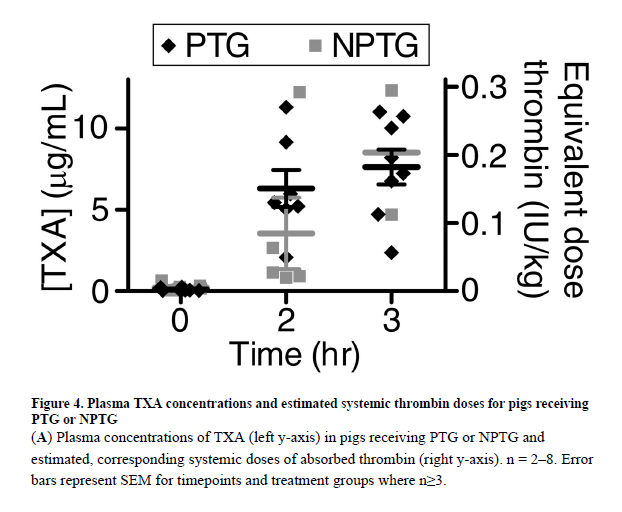
표 1
참고 자료
- US Burden of Disease Collaborators. The state of US health, 1990–2010: burden of diseases, injuries, and risk factors. JAMA. 2013; 310(6):591–608. [PubMed: 23842577]
- Murray CJ, Vos T, Lozano R, et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012; 380(9859):2197–223. [PubMed: 23245608]
- Eastridge BJ, Mabry RL, Seguin P, et al. Death on the battlefield (2001–2011): implications for the future of combat casualty care. J Trauma. 2012; 73(6 Suppl 5):S431–437.
- Pfeifer R, Tarkin IS, Rocos B, et al. Patterns of mortality and causes of death in polytrauma patients--has anything changed? Injury. 2009; 40(9):907–11. [PubMed: 19540488]
- Kauvar DS, Lefering R, Wade CE. Impact of hemorrhage on trauma outcome: an overview of epidemiology, clinical presentations, and therapeutic considerations. J Trauma. 2006; 60(6 Suppl):S3–11. [PubMed: 16763478]
- Kelly JF, Ritenour AE, McLaughlin DF, et al. Injury severity and causes of death from Operation Iraqi Freedom and Operation Enduring Freedom: 2003–2004 versus 2006. J Trauma. 2008; 64(2 Suppl):S21–26. [PubMed: 18376168]
- Eastridge BJ, Hardin M, Cantrell J, et al. Died of wounds on the battlefield: causation and implications for improving combat casualty care. J Trauma. 2011; 71(1 Suppl):S4–8. [PubMed: 21795876]
- Kragh JF Jr, Murphy C, Dubick MA, et al. New tourniquet device concepts for battlefield hemorrhage control. US Army Med Dep J. Apr-Jun;2011 :38–48. [PubMed: 21607905]
- Pannell D, Brisebois R, Talbot M, et al. Causes of death in Canadian Forces members deployed to Afghanistan and implications on tactical combat casualty care provision. J Trauma. 2011; 71(5 Suppl 1):S401–407. [PubMed: 22071995]
- Kragh JF, Kotwal RS, Cap AP, et al. Performance of junctional tourniquets in normal human volunteers. Prehosp Emerg Care. 2015; 19(3):391–398. [PubMed: 25494825]
- Kragh JF Jr, Murphy C, Steinbaugh J, et al. Prehospital emergency inguinal clamp controls hemorrhage in cadaver model. Mil Med. 2013; 178(7):799–805. [PubMed: 23820355]
- Kheirabadi BS, Terrazas IB, Hanson MA, et al. In vivo assessment of the Combat Ready Clamp to control junctional hemorrhage in swine. J Trauma. 2013; 74(5):1260–1265.
- Mann-Salinas EA, Kragh JF Jr. Dubick MA, et al Assessment of users to control simulated junctional hemorrhage with the combat ready clamp (CRoC). Int J Burns Trauma. 2013; 3(1):49–54. [PubMed: 23386985]
- Gates KS, Baer L, Holcomb JB. Prehospital emergency care: evaluation of the junctional emergency tourniquet tool with a perfused cadaver model. J Spec Oper Med. 2014; 14(1):40–44. [PubMed: 24604437]
- Baylis JB, Yeon JY, Thomson MH, et al. Self-propelled particles that transport cargo through flowing blood and halt hemorrhage. Sci Adv. 2015; 1(9):e1500379. [PubMed: 26601282]
- Kheirabadi BS, Arnaud F, McCarron R, et al. Development of a standard swine hemorrhage model for efficacy assessment of topical hemostatic agents. J Trauma. 2011; 71(1 Suppl):S139–146. [PubMed: 21795871]
- Ward KR, Tiba MH, Holbert WH, et al. Comparison of a new hemostatic agent to current combat hemostatic agents in a Swine model of lethal extremity arterial hemorrhage. J Trauma. 2007; 63(2):276–283. [PubMed: 17693824]
- Acheson EM, Kheirabadi BS, Deguzman R, et al. Comparison of hemorrhage control agents applied to lethal extremity arterial hemorrhages in swine. J Trauma. 2005; 59(4):865–874. [PubMed: 16374275]
- St John AE, Wang X, Lim EB, et al. Effects of rapid wound sealing on survival and blood loss in a swine model of lethal junctional arterial hemorrhage. J Trauma. 2015; 79(2):256–262.
- Regnier MA, Raux M, Le Manach Y, et al. Prognostic significance of blood lactate and lactate clearance in trauma patients. Anesthesiology. 2012; 117(6):1276–1288. [PubMed: 23168430]
- Odom SR, Howell MD, Silva GS, et al. Lactate clearance as a predictor of mortality in trauma patients. J Trauma. 2013; 74(4):999–1004.
- Zhang Z, Xu X. Lactate clearance is a useful biomarker for the prediction of all-cause mortality in critically ill patients: a systematic review and meta-analysis. Crit Care Med. 2014; 42(9):2118–2125. [PubMed: 24797375]
- Dezman ZD, Comer AC, Smith GS, et al. Failure to clear elevated lactate predicts 24-hour mortality in trauma patients. J Trauma. 2015; 79(4):580–585.
- Shakur H, Roberts I, Bautista R, et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010; 376(9734):23–32. [PubMed: 20554319]
- Fiechtner BK, Nuttall GA, Johnson ME, et al. Plasma tranexamic acid concentrations during cardiopulmonary bypass. Anesth Analg. 2001; 92(5):1131–1136. [PubMed: 11323334]
- Adkins RB, Foster JH. Experimental study of the genesis of fat embolism. Ann Surg. 1962; 156:515–527. [PubMed: 14011080]
- Heffernan JK, Ponce RA, Zuckerman LA, et al. Preclinical safety of recombinant human thrombin. Regul Toxicol Pharmacol. 2007; 47(1):48–58. [PubMed: 16971028]
'(MARCHE)² > 관련 자료' 카테고리의 다른 글
| [참고] 피부주름두께 측정을 통한 성인의 둔부 근육주사 바늘의 최적 길이 예측 (3) | 2024.12.07 |
|---|---|
| [번역] 방사능, 화학 정찰 및 통제 장비 (0) | 2024.12.05 |
| [번역] 응급 의료 서비스에서의 기흉 (1) | 2024.06.18 |
| [번역] JTS-CPG CBRN Injury Response Part Ⅱ: Medical Management of Chemical Agent Exposure (0) | 2024.05.26 |
| [번역] JTS-CPG CBRN Injury Response Part Ⅰ: Initial Response to CBRN Agents (0) | 2024.05.26 |

