염소(Chlorine)는 강한 자극성과 독성을 띠는 화학물질로, 대량으로 방출될 경우 신속한 대응을 필요로 한다. 일반적으로 염소 가스는 수분과 반응하여 염산(HCl)과 차아염소산(HOCl)을 생성하며, 이는 인체 및 환경에 심각한 피해를 줄 수 있다. 이러한 이유로, 염소 가스 제독에는 다양한 방식의 제독이 이루어지는데, 본 글에서는 소석회를 이용한 제독법을 알아보고자 한다.
물질 특성
염소 (鹽素, Chlorine)
- 화학식 : Cl₂
- 분자량: 70.90g/㏖
- 밀도: 3.21g/ℓ (0℃, 1 atm)
- 비점: -34.04℃
- 용해도: 물에 약간 녹음 (9.6g/ℓ, 25℃)
염소는 상온에서 황록색 또는 황색 기체로 존재하는 비금속 원소로, 원자번호 17번에 해당한다. 강한 산화력을 가지며, 또한 강한 자극성과 독성을 지닌다. 염소는 자연 상태에서 단독으로 존재하기보다는, 주로 염화나트륨(NaCl) 등 화합물 형태로 발견된다.
1774년 스웨덴의 화학자 Carl W. Scheele가 연망가니즈석(Pyrolusite, MnO₂, 이산화망간) 연구 중, 이를 염산과 반응시키자 황록색 기체가 발생하는 것을 식별(염소를 발견)*, 1810년 영국의 화학자 Humphry Davy가 이 물질이 원소임을 증명하고 이를 그리스어 Chloros (황록색)의 이름을 딴 Chlorine으로 명명했다.
\[
\text{NaCl} + H_2SO_4 \rightarrow \text{NaHSO}_4 + HCl \uparrow
\]
\[
HCl + H_2O \rightarrow HCl_{\mathrm{(aq)}}
\]
\[
HCl_{\mathrm{(aq)}} + MnO_2 \xrightarrow{\Delta} MnCl_2 + Cl_2 \uparrow + H_2O
\]
* Carl W. Scheele의 실험. 염산 용액에 이산화망간을 넣어 가열함으로 염소 기체가 발생함을 식별했다. 그러나 Scheele는 이를 그저 새로운 화합물로 여기고 '플로지스톤을 잃은 염산(dephlogisticated muriatic acid)' 정도로 생각했다.
소석회 (消石灰, Slaked lime)
- 화학식 : Ca(OH)₂
- 분자량: 74.09g/㏖
- 밀도: 2.21g/㎥
- 융점: 580℃ (이후 분해됨)
- 용해도: 물에 약간 녹음 (1.73g/ℓ, 20℃)
소석회는 Ca(OH)₂의 화학식을 가지는 수산화칼슘으로 이루어진 무기 화합물이다. 백색의 고체로, 분말 또는 결정 형태로 존재하며, 물에 저 용해성이고 포화용액을 석회수(Limewater)라고 부른다. 강염기성 화합물로 물과 혼합하면 pH 12-13의 강알칼리성을 보인다. 이산화탄소(CO₂)와 반응하여 탄산칼슘(CaCO₃)이 생성된다.
$$Ca(OH)_2+CO_2\to CaCO_3+H_2O$$
소석회 제조
소석회를 제조하는 과정은 다음과 같다.
$$CaCO_3\to CaO+CO_2\uparrow$$
$$CaO+H_2O\to Ca(OH)_2+열$$
- 탄산칼슘(석회석)을 약 900~1,000℃로 가열하여 이산화탄소를 제거하면 산화칼슘(CaO, 생석회)이 생성된다.
- 이 생석회에 물을 첨가하면 강한 발열 반응과 함께 수산화칼슘이 형성된다.
소석회가 염소를 제독하는 과정
소석회는 염소와 반응하면 차아염소산칼슘(Ca(OCl)₂)과 염화칼슘(CaCl₂), 그리고 물(H₂O)이 생성된다. 이 과정에서 생성된 차아염소산칼슘은 강한 산화력을 가지며 살균 및 소독 작용을 할 수 있으므로, 이 과정을 염소 노출 환경에 대한 제독 목적으로 활용하는 것이다.
$$Ca(OH)_2 + Cl_2 \to$$
$$Ca(OCl)_2 + CaCl_2 + H_2O$$
- 소석회는 분말 또는 물에 희석하여 슬러리 형태로 사용한다. (군에서는 분말 살포기를 사용)
- 소석회가 염소 가스와 접촉하면 상기 화학반응이 발생하며 반응 화합물을 발생시키고, 또한 노출 현장을 제독한다. 반응 후 남은 화합물들은 수용성이기 때문에 물로 세척이 가능하며, 환경에 큰 영향을 미치지는 않는다.
염소 가스와 소석회의 반응량
제독 간 염소 가스가 충분히 중화되지 않으면 잔여 독성이 잔존할 수 있으므로, 적절한 용량을 투입해야 한다. 염소 가스 1㏖ (70.90g)의 반응에는 소석회 1㏖(74.09g)이 필요하다 (1:1). 염소 가스 100g을 중화하는 데 필요한 이론적 소석회 용량을 계산하면 104.5g이 필요한 셈이다.
다음의 수식을 통해 필요량을 측정할 수 있다.
$$m_{Ca(OH)_2}=\left ( m_{Cl_2}\times \frac{M_{Ca(OH)_2}}{M_{Cl_2}} \right )$$
고려할 사항
- 또한 생성된 차아염소산칼슘은 강한 산화력이 있으므로 피부에 닿으면 화상을 입을 수 있다. 때문에 제독 간에는 적절한 개인보호장비(PPE)를 착용하여야 한다.
여기서부터는 재미로 :)
제1차 세계대전 중 화학무기 용례
제1차 세계대전이 한창이던 1915년 독일제국 육군(이하 독일군)의 서부전선에서는 (규제 법령이 없던 것은 아니지만) 최초로 독가스를 무기로서 사용한 사례를 확인할 수 있다:
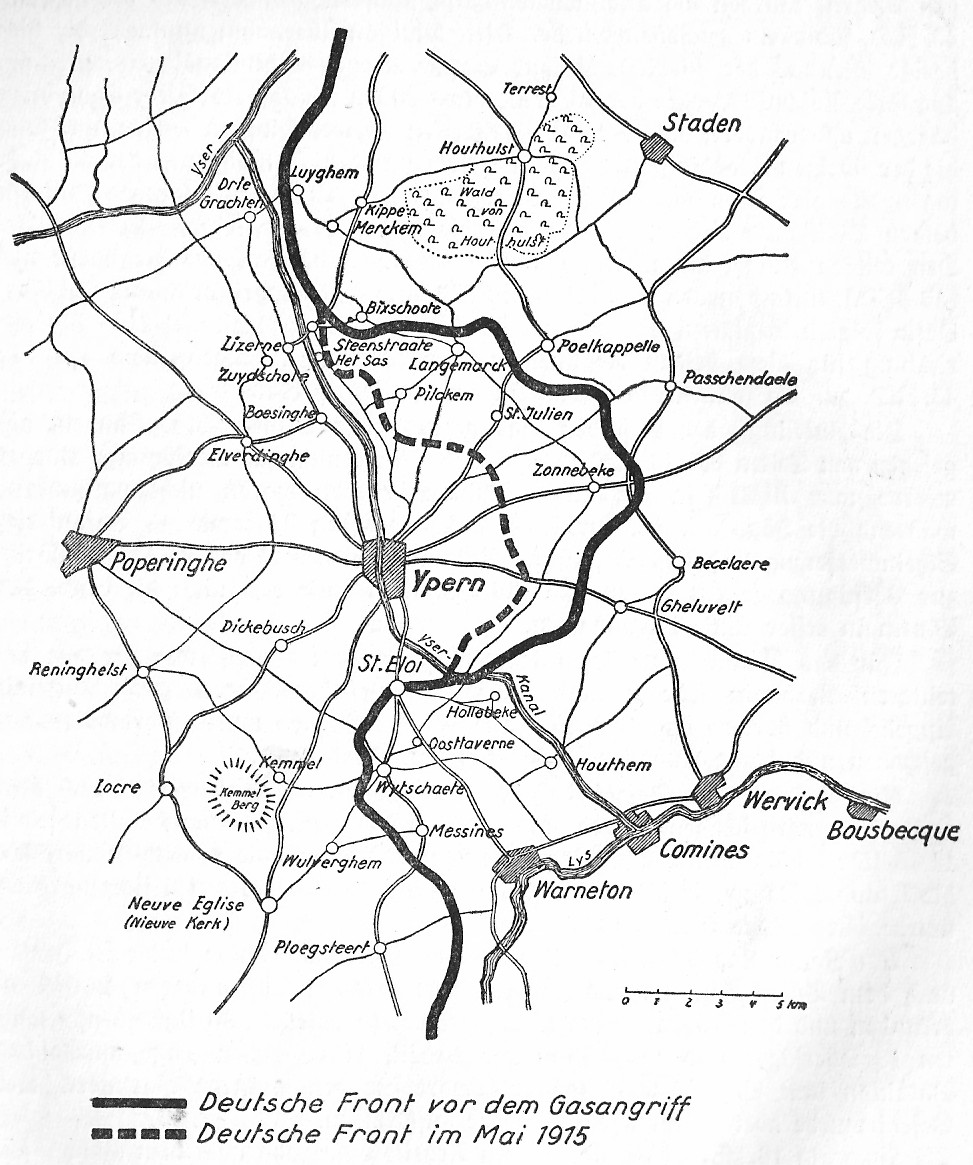
제1차 세계대전 중 독일군은 1915년 4월 22일부터 플랑드르 서부 전선의 연합국 진지를 돌파하기 위한 이프르(벨기에) 전선에 공세를 개시한다.
당시 발생한 전투는 크게 4가지로 분류할 수 있다.
- Gravenstafel 전투 (1915년 4월 22 ~ 23일)
- Saint Julien 전투 (1915년 4월 24일 ~ 5월 4일)
- Frezenberg 전투 (1915년 5월 8일 ~ 13일)
- Bellewaarde 전투 (1915년 5월 24일 ~ 25일)
이를 묶어 제2차 이프르 전투라고 한다... 독일에서는 제2차 플랑드르 전투라고 부르나봄.
아무튼 1915년 4월 22일 오후 6시, Steenstrate와 Poelkapelle 사이에서 독일군 제35개척연대(Pionier-Regiment Nr. 35)는 약 6,000 (5,730)개의 강철 실린더에서 약 167톤에 달하는 염소 가스를 방출했다. 가스는 프랑스군의 참호를 향해 약 6km에 걸쳐 뻗어있었고, 공기보다 무거운 염소 가스의 특징으로 인해 모두 연합군 참호와 진지로 가라앉아버렸다. 이를 통해 수 천의 사상자와 최소 1,000명으로 추산되는 사망자가 발생했다. 그러나 당시 프랑스 군은 방독면을 포함한 개인 보호 장비를 소지하지 않고 있었다.
이를 통해 Karl von Kathen 장군이 이끄는 독일군 제23예비군단은 적의 큰 저항없이 이저 운하(Yserkanal, Yserlee)의 연합군 진지를 점령하고 3~4km 깊이로 진격하는 데 성공했다고.
그 강철 실린더는?

당시 사용한 캐니스터(그러니까, 실린더)의 제원은 다음과 같다.
- 재질: 강철
- 길이: 약 1.2m
- 직경: 약 15cm
- 무게: 약 40kg (공중량)
- 충전 용량: 약 20kg의 액화 염소 가스
또한, 이런 식으로 운용되었다. →
이프르 전투에서 독일군이 포격이 아닌, 공병 살포로 방향을 비튼 것은, 1899년 5월 18일부터 7월 29일까지 네덜란드 헤이그에서 진행된 제1차 만국평화회의 (Vredesconferenties van Den Haag, 제1차 헤이그 협약)의 선언의 비중이 컸다.
이 회의에서는 크게 6가지 사안에 대하여 다루고 선언하였다: 출처
- 국제 분쟁의 평화적 해결을 위한 협약
- 육상전의 법률 및 관습에 대한 협약
- 1864년 8월 22일 제네바 협약 원칙의 해상전 적용에 대한 협약
- 기구 또는 기타 새로운 수단에서 발사체 및 폭발물을 투사하는 것을 금지하는 데에 대한 선언
- 질식 또는 유독 가스를 살포하기 위한 목적으로만 사용되는 발사체(Projectielen)의 운용을 금지하는 데에 대한 선언
- 인체에서 쉽게 팽창하거나 평평해지는 총알, 예를 들어 맨들이 코어를 완전히 덮지 않거나 절개부로 만들어진 단단한 맨틀을 가진 총알의 사용을 금지하는 데에 대한 선언
프로이센 시절 서명한 내용이었으나, 이번 전쟁에서 독일 제국은 체결된지 15년밖에 지나지 않은 조약을 어기고 주변국의 큰 반발을 우려해 발사체(Projectielen)를 사용하는 대신, 캐니스터를 이용한 살포 방법을 택하는 꼼수를 취했다.
그 실린더를 이용한 공격 위력은?
이거 그냥 재미로 구해보는 거다. 진지한 거 아님.
1. 염소 가스 총량 계산
- 염소 가스 충전량
- $M_{cylinder} = 20kg$
- 사용된 총 실린더 수
- $N_{cylinders} = 5,730$
- 총 염소 가스의 질량
- $M_{total} = M_{cylinder} \times N_{cylinders}$
- $ = 114,600kg$
2. 염소가스 기체 부피 계산
- 염소 가스의 밀도 (STP 기준)
- $\rho Cl_2=3.214 kg/m^3$
- 염소 가스의 총 부피
- $V_{Cl_2} = \frac{M_{total}}{\rho Cl_2} = \frac{114,600}{3.214}$
- $\approx 35,667m^3$
3. 가스 확산 지역 부피 계산
- 염소 가스가 살포된 지역의 크기
- $W = 6,000m$
- $D = 4,000m$
- $H =1.5m$
- 총 공간 부피
- $V_{battlefield}=W\times D\times H $
- $=6,000\times 4,000\times 1.5$
- $=36,000,000m^3$
4. 염소 가스 농도 계산
- 농도(단위: ppm)는 가스 부피를 전체 부피로 나눈 후, 백만 단위로 변환한다:
- $C_{ppm}=\left [ \left ( \frac{V_{Cl_2}}{V_{battlefiled}} \times 10^6 \right ) \right ]$
- $= \left [ \left ( \frac{35,667}{36,000,000}\times 10^6 \right ) \right ]$
- $\approx 990,458 ppm$
5. 산출된 농도를 ㎎/㎥로 변환
- 염소 가스의 밀도를 이용하여 ㎎/㎥으로 변환 (1ppm = 3.214㎎/㎥)
- $C_{ppm}/m^3=C_{ppm}\times 3.214$
- $= 990,458\times 3.214 \approx 3,168,333mg/m^3$
이는 즉각적인 질식과 폐부종을 유발할 수 있는 치명적인 농도로, 일반적인 치사 농도(800~1,000ppm)를 약 990배 초과하는 수치다.
'전술 장비 및 술기 > CBRN' 카테고리의 다른 글
| 핵폭발과 버섯구름 — 그 물리학적 해부 (2부) (0) | 2025.04.24 |
|---|---|
| 핵폭발과 버섯 구름 — 그 물리학적 해부 (1부) (0) | 2025.04.24 |
| AP4C: Universal Chemical Detector (0) | 2025.01.08 |
| [정리] Radiogardase® / Prussian Blue (0) | 2025.01.06 |
| 흑사병: 정말 몽골군은 페스트균에 감염된 시체를 투척했을까? (2) | 2024.12.18 |
